Pada halaman ini akan dibahas mengenai Simulator Identifikasi Kearomatikan Molekul. Semua informasi ini kami rangkum dari berbagai sumber. Semoga memberikan faedah bagi kita semua.
Salah satu bagian penting dalam pokok bahasan kimia organik adalah mengidentifikasi suatu molekul apakah bersifat aromatik atau bukan aromatik. Kearomatikan (aromatisitas) ini akan menentukan banyak sifat suatu molekul serta kemungkinan bagaimana reaksi terjadi. Untuk mengidentifikasinya perlu dilakukan pemeriksaan setahap demi setahap secara cermat hingga diperoleh kesimpulan yang benar.
Berikut ini alat yang dapat digunakan untuk membantu membuat cek lis dalam mengidentifikasi apakah suatu molekul organik itu bersifat aromatik, antiaromatik, atau nonaromatik. Jika hasil tidak tampil silakan Ubah https://... menjadi http:// pada browser anda, atau klik di sini
Mohon saran dan koreksi bila ada kekurangtepatan pada simulator di atas. Bila berkenan silakan menuliskannya pada kotak komentar di bawah ini. Terima kasih.
- Bentuk Siklik atau Bukan Siklik
Untuk mengindentifikasi bentuk harus melihat struktur molekulnya. Bila struktur molekul berbentuk rantai tertutup maka itu dikatakan siklik, bila rantai terbuka maka itu dikatakan bukan siklik atau nonsiklik. - Terkonjugasi atau Tidak Terkonjugasi
Istilah terkonjugasi ini mengacu pada pola susunan ikatan rangkap dan ikatan tunggal yang terselang-seling atau bergantian. Kadang adanya pasangan elektron bebas yang terlibat delokalisasi elektron juga menjadi bagian dalam selang-seling dalam struktur molekul. Bila susunannya berselang-seling itu dikatakan terkonjugasi, bila tidak berselang-seling (atau ada yang terlewatkan) maka itu dikatakan tidak terkonjugasi.
Contoh:
- Jumlah Ikatan π
Menentukan jumlah ikatan π dapat dilihat ada berapa ikatan rangkap (double bond) dalam struktur molekul.
Contoh: - Jumlah Pasangan Elektron Bebas π (PEB π)
Menentukan PEB π dapat dilihat ada berapa PEB π yang terlibat dalam konjugasi dalam struktur molekul.
Contoh:
- Jumlah Radikal Bebas
Menentukan radikal bebas dapat dilihat ada berapa radikal bebas dalam struktur molekul. Biasa radikal bebas (elektron tunggal menyendiri) disimbolkan dengan tanda titik (dot) di sekitar atom yang memilikinya.
Contoh: - Kesesuaian dengan Aturan Huckel
Apakah total elektron π + radikal bebas yang dimiliki molekul sesuai dengan aturan Huckel dapat membandingkan dengan rumus aturan Huckel (4n + 2). n = bilangan bilat (0, 1, 2, 3, ....). Bila sesuai dengan aturan tersebut maka ada dua kemungkinan bahwa molekul tersebut aromatik atau antiaromatik. Selain itu maka dikatakan nonaromatik.
- Memiliki orbital hibrida sp2
Cara mudah menentukan apa pada suatu atom dalam molekul memiliki orbital hibrida sp2, hitunglah jumlah atom yang berikatan dengan atom tersebut. Misal sebuah atom C yang berikatan dengan 3 atom lain (biasa atom apa saja) maka dipastikan atom C tersebut memiliki orbital hibrida sp2.
Contoh: - Memiliki orbital hibrida sp3
Cara mudah menentukan apa pada suatu atom dalam molekul memiliki orbital hibrida sp3, hitunglah jumlah atom yang berikatan dengan atom tersebut. Misal sebuah atom C yang berikatan dengan 4 atom lain (biasa atom apa saja) maka dipastikan atom C tersebut memiliki orbital hibrida sp3. - Bentuk Struktur Molekul 2D atau 3D
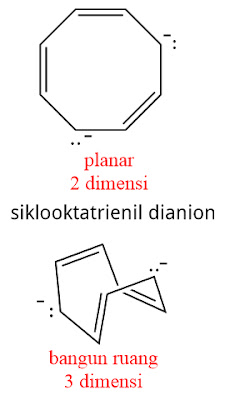
Menentukan struktur molekul apakah planar/datar (2D = 2 dimensi) atau apakah berupa bangun-ruang (3D = 3 dimensi) agak sulit memang terutama pada molekul yang tidak mempunyai orbital hibrida sp3. Namun ini dapat diperkirakan, bahwa molekul-molekul membentuk cincin yang besar (walaupun semua atom inti berorbital hibrida sp2), ia berpotensi memiliki bentuk struktur 3D. Sementara itu molekul yang membentuk cincin relatif kecil biasanya berupa 2D atau planar. Patut diingat bahwa bila dijumpai molekul yang memiliki orbital sp3. dipastikan strukturnya berbentuk bangun-ruang aliar tidak planar.
Semakin banyak membaca dan menghadapi banyak struktur molekul akan sangat membantu dalam menentukan apakah suatu molekul itu berbentuk planar atau bangun-ruang.
Contoh: - Kesimpulan
Bila semua syarat terpenuhi maka molekul itu bersifat aromatik, dan bila salah satu saja tidak terpenuhi maka dikatakan bukan aromatik.
Aromatik ⇒ siklik, terkonjugasi, jumlah elektron π (beserta radikal bila ada) mengikuti aturan Huckel (4n + 2), struktur planar, berorbital sp2
Antiaromatik ⇒ siklik, terkonjugasi, jumlah elektron π (beserta radikal bila ada) tidak mengikuti aturan Huckel tetapi memiliki kelipatan dengan rumus 4n + 4, struktur planar, berorbital sp2
Nonaromatik ⇒ tidak memenuhi salah satu syarat siklik pada aromatik atau antiaromatik
Berikut ini alat yang dapat digunakan untuk membantu membuat cek lis dalam mengidentifikasi apakah suatu molekul organik itu bersifat aromatik, antiaromatik, atau nonaromatik. Jika hasil tidak tampil silakan Ubah https://... menjadi http:// pada browser anda, atau klik di sini
Mohon saran dan koreksi bila ada kekurangtepatan pada simulator di atas. Bila berkenan silakan menuliskannya pada kotak komentar di bawah ini. Terima kasih.







Tidak ada komentar:
Posting Komentar