Pada halaman ini akan dibahas mengenai Menghitung Jumlah Atom dalam Sel Satuan Kristal dengan Kalkulator. Semua informasi ini kami rangkum dari berbagai sumber. Semoga memberikan faedah bagi kita semua.
Bahasan tentang struktur kristal di jenjang SMA memang tidak menjadi pokok bahasan, namun untuk topik olimpiade kimia kadang hal ini muncul. Yang diulas biasa memang tidak terlalu rumit untuk olimpiade tingkat kabupaten/kota maupun provinsi. Cerita menjadi berbeda manakala sudah di tingkat nasional apalagi internasional. Memang bahasan ini baru ada di mata kuliah kimia dasar di perguruan tinggi.
Sebagai pengayaan untuk siswa SMA tidak ada salahnya dikenalkan sedikit tentang struktur kristal, bagaimana menghitung jumlah atom dalam sel satuan (unit cell), bagaimana menentukan struktur kristal dari data difraksi sinar X, menentukan densitas/kerapatan atom dalam satuan sel tertentu. Alat hitung yang terdapat dalam postingan ini merupakan pengembangan ide tahap awal dan bertujuan untuk memberikan konfirmasi atas soal-soal relatif sederhana pada olimpiade kimia.
Bentuk kisi kristal secara umum terdapat 3 macam:
Referensi berikut juga akan lebih mudah untuk disimak:
Prinsip penentuan jumlah atom-atom dalam sebuah kisi kristal atau sering disebut sel satuan:
Bagi pengguna Sistem Operasi Windows 10 dapat mengunduh dan memasang aplikasi kecil untuk sekadar melihat bagaimana struktur 3 dimentasi seperti pada contoh gambar di atas. Berikut ini pranalanya. https://www.microsoft.com/en-id/store/p/ball-stick/9nblggh4s694?ocid=badge&rtc=1
Dapat pula mengunduh dan memasang aplikasi crystalmaker, crystalmaker versi demo yang ringan pun sudah cukup bila hanya untuk perkenalan. Klik pranala tadi untuk mengunduhnya.
Berikut ini adalah simulator untuk menentukan jumlah atom dalam sel satuan kisi kristal yang dapat digunakan untuk mengkonfirmasi dari latihan soal yang mungkin dijumpai. Andai tidak yakin :)
Sebagai contoh hitungan secara manual dapat digunakan contoh soal berikut:
Nitrida suatu logam mempunyai atom nitrogen masing-masing pada setiap pojok (corner) kubus, dan atom logam ada pada setiap rusuk (edge) kubus. Manakah rumus empiris dari nitrida tersebut?
a. Ba3N2
b. Na3N
c. AlN
d. Ti3N4
Penyelesaian:
Setiap kubus memiliki 8 pojok (sudut ruang) dan setiap atom di pojok tersebut akan dibagi dengan 8 kubus yang berlainan dari unit lain; oleh karena itu hanya akan terdapat 1/8 atom di setiap sudut kubus dalam sel satuan. Jadi total pada sudut ruang kubus: 1/8 × 8 atom N = 1 atom N.
Setiap kubus memiliki 12 rusuk dan setiap rusuk akan terhubung dengan 4 kubus berlainan, dalam setiap kubus akan ada hanya 1/4 atom. Jadi keseluruhan atom pada rusuk = 1/4 × 12 = 3 atom logam.
Satu-satunya pilihan untuk memenuhi kriteria di atas adalah pilihan jawaban b, Na3N.
Sebagai latihan dapat menggunakan contoh sel satuan yang ilustrasinya di atas (mulai sel satuan A, B, C, dan Rutil.
Untuk menggunakan alat hitung di bawah ini silakan isi sesuai data yang diketahui, setelah selesai sila klik di luar kotak input untuk melihat hasilnya.
Jika Perhitungan tidak muncul Silakan KLIK DISINI
Pada postingan berikutnya akan disajikan kalkulator untuk menentukan densitas atom dalam sel satuan, menentukan jari-jari atom dalam sel satuan, menentukan massa dan lain-lain.
Silakan tinggalkan komentar bila berkenan untuk menyampaikan saran atau pertanyaan. Terima kasih.
Sebagai pengayaan untuk siswa SMA tidak ada salahnya dikenalkan sedikit tentang struktur kristal, bagaimana menghitung jumlah atom dalam sel satuan (unit cell), bagaimana menentukan struktur kristal dari data difraksi sinar X, menentukan densitas/kerapatan atom dalam satuan sel tertentu. Alat hitung yang terdapat dalam postingan ini merupakan pengembangan ide tahap awal dan bertujuan untuk memberikan konfirmasi atas soal-soal relatif sederhana pada olimpiade kimia.
Bentuk kisi kristal secara umum terdapat 3 macam:
- Kubus sederhana (primitive/simple cubic = pc/sc)

- Kubus berpusat badan (body cubic center = bcc)

- Kubus berpusat muka (face cubic center = fcc)

Referensi berikut juga akan lebih mudah untuk disimak:
- http://chemed.chem.purdue.edu/genchem/topicreview/bp/ch13/unitcell.php
- http://www.chemtube3d.com/solidstate/_table.htm
- http://spaceflight.esa.int/impress/text/education/Glossary/Glossary_B.html
Prinsip penentuan jumlah atom-atom dalam sebuah kisi kristal atau sering disebut sel satuan:
- Atom yang terletak dalam badan sel satuan dihitung sebagai atom yang utuh.
- Atom yang terletak pada muka (permukaan) sel satuan dihitung 1/2 atom.
- Atom yang terletak pada sisi/rusuk sel satuan dihitung 1/4 atom.
- Atom yang terletak pada pojok (sudut) sel satuan dihitung 1/8 atom.
- Jumlah atom keseluruhan dalam sel satuan dihitung dari jumlah setiap atom yang terletak pada sel satuan.
 |
| Sumber dari http://chemed.chem.purdue.edu |
Bagi pengguna Sistem Operasi Windows 10 dapat mengunduh dan memasang aplikasi kecil untuk sekadar melihat bagaimana struktur 3 dimentasi seperti pada contoh gambar di atas. Berikut ini pranalanya. https://www.microsoft.com/en-id/store/p/ball-stick/9nblggh4s694?ocid=badge&rtc=1
Dapat pula mengunduh dan memasang aplikasi crystalmaker, crystalmaker versi demo yang ringan pun sudah cukup bila hanya untuk perkenalan. Klik pranala tadi untuk mengunduhnya.
Berikut ini adalah simulator untuk menentukan jumlah atom dalam sel satuan kisi kristal yang dapat digunakan untuk mengkonfirmasi dari latihan soal yang mungkin dijumpai. Andai tidak yakin :)
 |
| Sel satuan A |
 |
| Sel satuan B |
 |
| Sel satuan C |
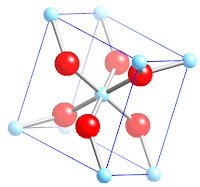 |
| Sel satuan Rutil (TiO2) |
 |
| Sel satuan Rutil (TiO2) dari sisi lain. |
Sebagai contoh hitungan secara manual dapat digunakan contoh soal berikut:
Nitrida suatu logam mempunyai atom nitrogen masing-masing pada setiap pojok (corner) kubus, dan atom logam ada pada setiap rusuk (edge) kubus. Manakah rumus empiris dari nitrida tersebut?
a. Ba3N2
b. Na3N
c. AlN
d. Ti3N4
Penyelesaian:
Setiap kubus memiliki 8 pojok (sudut ruang) dan setiap atom di pojok tersebut akan dibagi dengan 8 kubus yang berlainan dari unit lain; oleh karena itu hanya akan terdapat 1/8 atom di setiap sudut kubus dalam sel satuan. Jadi total pada sudut ruang kubus: 1/8 × 8 atom N = 1 atom N.
Setiap kubus memiliki 12 rusuk dan setiap rusuk akan terhubung dengan 4 kubus berlainan, dalam setiap kubus akan ada hanya 1/4 atom. Jadi keseluruhan atom pada rusuk = 1/4 × 12 = 3 atom logam.
Satu-satunya pilihan untuk memenuhi kriteria di atas adalah pilihan jawaban b, Na3N.
Sebagai latihan dapat menggunakan contoh sel satuan yang ilustrasinya di atas (mulai sel satuan A, B, C, dan Rutil.
Untuk menggunakan alat hitung di bawah ini silakan isi sesuai data yang diketahui, setelah selesai sila klik di luar kotak input untuk melihat hasilnya.
Jika Perhitungan tidak muncul Silakan KLIK DISINI
Pada postingan berikutnya akan disajikan kalkulator untuk menentukan densitas atom dalam sel satuan, menentukan jari-jari atom dalam sel satuan, menentukan massa dan lain-lain.
Silakan tinggalkan komentar bila berkenan untuk menyampaikan saran atau pertanyaan. Terima kasih.
Tidak ada komentar:
Posting Komentar