Pada halaman ini akan dibahas mengenai Pembahasan Soal Pilihan Ganda OSP Kimia 2017. Semua informasi ini kami rangkum dari berbagai sumber. Semoga memberikan faedah bagi kita semua.
Berikut ini pembahasan soal Olimpiade Sains Tingkat Provinsi Bidang Kimia Tahun 2017. Saat ini baru beberapa nomor yang diketik dan dibahas. Mudahan di waktu selanjutnya bisa diselesaikan pengetikan semua di sela waktu luang admin.
Soal Nomor 1 OSP Kimia 2017
Larutan pekat asam klorida HCl adalah larutan 36% w/w HCl dalam air. Larutan ini memiliki rapat massa 1,18 g/cm3. Konsentrasi larutan tersebut adalah
A. 1,16 M
B. 9,87 M
C. 11,65 M
D. 19,70 M
E. 23,30 M
Pembahasan Soal Nomor 1 OSP Kimia 2017
Kadar HCl pekat 36% berat/berat, rapat massa atau massa jenis 1,18 g/cm3, bila 1000 cm3 (1000 mL atau 1 L ) ini setara HCl sebanyak 1180 g.
Massa molar HCl dari data tabel periodik yang diberikan = 35,45 + 1,008 = 36,458 g/mol
Di misalkan terdapat 1 L = 1180 g × 36% = 424,8 g
Jumlah HCl = 424,8 g : 36,458 g/mol = 11,65175 M
Jawaban yang tepat adalah C. 11,65 M
Soal Nomor 2 OSP Kimia 2017
Suatu reaksi kimia dapat disebut sebagai suatu reaksi redoks jika:
(1) Mengalami perubahan bilangan oksidasi yang lebih tinggi dari semula
(2) Kehilangan elektron
(3) Menerima proton
(4) Bersenyawa dengan oksigen
(5) Berubah menjadi fasa gas
Jawaban yang paling tepat adalah
A. 1, 2, 3
B. 1, 2, 4
C. 1, 3, 5
D. 1, 3, 4
E. 2, 4, 5
Pembahasan Soal Nomor 2 OSP Kimia 2017
Konsep reaksi redoks dapat ditinjau berdasar:
· Ada-tidaknya perubahan bilangan oksidasi
· Lepas-terima elektron
· Lepas-terima oksigen
· Lepas-terima hidrogen
Jawaban yang tepat adalah B
Di antara kombinasi pasangan yang tepat adalah 1, 2, 4.
Soal Nomor 3 OSP Kimia 2017
Dari reaksi-reaksi berikut:
(1) Cl2 + IO3– + 2OH– → IO4– + 2Cl– + H2O
(2) Cl2 + 2OH– → ClO– + Cl– + H2O
(3) 3ClO– → ClO3– + 2Cl–
(4) H2 + Cl2 → 2HCl
Yang merupakan reaksi disproporsionasi (auto oksidasi-reduksi) adalah
A. 1, 2, 3
B. 2, 4
C. 2, 3
D. 3, 4
E. 1, 3, 4
Pembahasan Soal Nomor 3 OSP Kimia 2017
Ciri kasad mata reaksi disproporsionasi adalah adanya 1 macam spesi di ruas kiri kemudian berubah menjadi 2 macam spesi, dan terdapat perubahan bilangan oksidasi meningkat bila dipasangkan dengan 1 spesi di ruas kanan, serta terdapat perubahan bilangan oksidasi menurun bila dipasangan dengan 1 spesi lainnya di ruas kanan juga.
Jawaban yang tepat adalah C. 2 dan 3.
Soal Nomor 4 OSP Kimia 2017
Molalitas senyawa para-diklorobenzena (C6H4Cl2) dalam suatu larutan yang dibuat dengan cara melarutkan 2,65 g C6H4Cl2 dalam 50 mL benzena (kerapatan = 0,879 g/mL) adalah
A. 0,018 m
B. 0,041 m
C. 0,180 m
D. 0,410 m
E. 1,810 m
Pembahasan Soal Nomor 4 OSP Kimia 2017
1 molal = 1 mol zat terlarut dalam setiap 1 kg pelarut = 1 mol/kg
Massa C6H4Cl2 = 2,65 g; Massa molar C6H4Cl2 = (6×12,01+4×1,008+2×35,45) = 146,992 g/mol
Jumlah C6H4Cl2 = 2,65 g : 146,992 g/mol = 0,018028 mol
Massa pelarut benzena 50 mL × 0,879 g/mL = 43,95 g = 0,04395 kg
Molalitas = 0,018028 mol : 0,04395 kg = 0,410198 mol/kg = 0,41 molal
Jawaban yang tepat adalah D. 0,41 molal
Soal Nomor 5 OSP Kimia 2017
Sebanyak 10 g parafin, C20H42 , suatu zat terlarut yang tak mudah menguap, dilarutkan dalam 50 g benzena, C6H6. Pada suhu 53 oC, tekanan uap murni benzena adalah 300 torr. Tekanan uap larutan pada suhu tersebut adalah
A. 298 torr
B. 292 torr
C. 284 torr
D. 275 torr
E. 267 torr
Pembahasan Soal Nomor 5 OSP Kimia 2017
10 g C20H42 = 10 g : 282,536 g/mol = 0,035394 mol
50 g C6H6 = 50 g : 78.108 g/mol = 0,640139 mol
Fraksi mol C20H42 dalam benzena = 0,035394 mol : (0,035394 + 0,640139) mol = 0,052394
∆P = Fraksi mol C20H42 dalam benzena × Po Benzena
∆P = 0,052394 × 300 torr
∆P = 15,71825 torr
Tekanan uap larutan = Po – ∆P
Tekanan uap larutan = (300 – 15,71825) torr
Tekanan uap larutan = 284.2818 torr ≈ 284 torr
Jawaban yang tepat adalah C. 284 torr
Soal Nomor 6 OSP Kimia 2017
Kreatinin adalah produk samping dari metabolisme nitrogen yang dapat digunakan untuk indikasi fungsi renal. Sebanyak 4,04 g sampel kreatinin dilarutkan dalam air menghasilkan 100 mL larutan dengan tekanan osmosis sebesar 8,73 mmHg pada 25 oC. Massa molekul kreatinin adalah
A. 4,3 × 105 g/mol
B. 8,6 × 105 g/mol
C. 4,3 × 104 g/mol
D. 8,6 × 104 g/mol
E. 1,3 × 103 g/mol
Pembahasan Soal Nomor 6 OSP Kimia 2017
Bahasan Sifat Koligatif Larutan
Tekanan osmosis larutan (p)
p = MRT → p = (nRT)/V
R = 0,08205 L.atm/mol.K
T = (25 + 273) K = 298 K
V = 100 mL = 0,1 L
p = 8,73 mmHg : 760 mmHg/atm = 0,011487 atm
→ p = (massa zat/massa molar zat)RT / V
→ massa molar zat = (massa zat × R × T)/(p.V)
→ massa molar zat = (4,04 g × 0,08205 L.atm/mol.K × 298 K) : (0.011487 atm × 0,1 L)
→ massa molar zat = 85995,47 g/mol ≈ 8,6 × 104 g/mol
Jawaban yang tepat adalah D. 8,6 × 104 g/mol
Soal Nomor 7 OSP Kimia 2017
Sampel senyawa dengan berat 7,85 g memiliki rumus empiris C5H4, dilarutkan dalam 301 g benzena. Titik beku larutan ini 1,05 oC di bawah titik beku benzena murni. (diketahui Kf benzena = 5,12 oC/m). Rumus molekul senyawa ini adalah
A. C5H4
B. C10H8
C. C15H12
D. C20H1
E. C25H20
Pembahasan Soal Nomor 7 OSP Kimia 2017
Bahasan Sifat Koligatif Larutan
∆Tf = m × Kf
1,05 = m × 5,12 oC/m
m = 1,05 : 5,12 oC/m
m = 0,205078 molal
m = n/(kg pelarut)
n = m × kg pelarut
n = 0,205078 molal × 0,301 kg
n = 0,061729 mol
massa molar zat = massa zat : n zat
(C5H4)x = 7,85 g : 0,061729 mol
(C5H4)x = 127.1698 g/mol
64,082 g/mol x = 127,1698 g/mol
x = 127,1696 : 64,082
x = 1.984485
x ≈ 2
Rumus molekul zat tersebut = (C5H4)2 = C10H8
Jawaban yang tepat adalah B. C10H8
Soal Nomor 8 OSP Kimia 2017
Suatu larutan metanol 60% dalam air membentuk sistem azeotrop, sehingga ketika dilakukan distilasi sederhana tidak akan memisah dengan sempurna. Di antara pernyataan berikut:
(1) ∆Hpelarutan metanol-air < 0 (eksoterm)
(2) Larutan metanol-air mengalami penyimpangan positif hukum Raoult
(3) Interaksi metanol-air > interaksi metanol-metanol; interaksi air-air
(4) ∆Vpelarutan metanol-air > 0 (endoterm)
Yang dapat menjelaskan fenomena di atas adalah
A. 1, 2, dan 3
B. 1 dan 3
C. 2 dan 4
D. 1
E. 4
Pembahasan Soal Nomor 8 OSP Kimia 2017
Jawaban yang tepat adalah A
Soal Nomor 9 OSP Kimia 2017
Di antara molekul berikut ini

Yang mempunyai struktur (struktur-struktur) titik Lewis yang benar adalah
A. 1, 2, dan 3
B. Hanya 1 dan 2
C. Hanya 2 dan 3
D. Hanya 2
E. Hanya 3
Pembahasan Soal Nomor 9 OSP Kimia 2017
Atom pusat suatu molekul yang dalam sistem periodik berada pada periode 2 biasanya akan stabil bila memiliki 8 elektron yang mengitarinya.
Atom pusat yang dalam sistem periodik unsur berada pada periode 3 atau lebih tinggi seperti S, P, Cl, Br, I, bisa saja (boleh) tidak mengikuti kaidah oktet, atau sering disebut dengan mengikuti kaidah oktet yang diperluas, boleh lebih dari 8 elektron yang berada di sekitarnya.
Molekul pertama dan kedua sudah benar dengan alasan di atas, molekul ketiga tidak benar karena N hanya sanggup menampung 8 elektron atau kurang tetapi tidak akan lebih. Pada molekul ketiga N “memiliki” 10 elektron yang ada di sekitarnya.
Jawaban yang tepat adalah B. Hanya 1 dan 2.
Soal Nomor 10 OSP Kimia 2017
Metilbenzoat, disebut juga “minyak Niobe”, digunkan dalam parfum (minyak-wangi), memiliki struktur berikut.
Hibridisasi atom karbon 1, 2 dan 3 dalam struktur minyak Niobe di atas berturut-turut adalah
A. sp, sp, sp2
B. sp, sp2, sp3
C. sp2, sp2, sp3
D. sp2, sp2, sp2
E. sp, sp, sp3
Pembahasan Soal Nomor 10 OSP Kimia 2017
Atom C yang hanya mempunyai ikatan singel saja, hibridisasinya adalah sp3
Atom C yang hanya mempunyai sebuah ikatan dobel, hibridisasinya adalah sp2
Atom C yang hanya mempunyai ikatan tripel, hibridisasinya adalah sp
Jawaban yang tepat adalah C. sp2, sp2, sp3
Soal Nomor 11 OSP Kimia 2017
Dalam pembakaran sempurna gas asetilena, C2H2, perubahan hibridisasi yang dapat terjadi pada atom karbon (bila ada) adalah
A. sp3 ke sp
B. sp2 ke sp3
C. sp2 ke sp
D. sp ke sp3
E. sp ke sp
Pembahasan Soal Nomor 11 OSP Kimia 2017
Reaksi kimia: C2H2 + 3/2 O2 → 2CO2 + H2O
Atom C yang hanya mempunyai ikatan singel saja, hibridisasinya adalah sp3
Atom C yang hanya mempunyai sebuah ikatan dobel, hibridisasinya adalah sp2
Atom C yang hanya mempunyai ikatan tripel atau 2 ikatan dobel, hibridisasinya adalah sp
Jawaban yang tepat adalah E. sp ke sp
Soal Nomor 12 OSP Kimia 2017
Jumlah ikatan pi (𝝅) yang terdapat dalam molekul berikut ini adalah
A. 2
B. 4
C. 6
D. 7
E. 10
Pembahasan Soal Nomor 12 OSP Kimia 2017
Dalam setiap ikatan singel hanya terdapat 1 ikatan 𝞂, dalam setiap ikatan dobel terdapat 1 ikatan 𝞂 dan 1 ikatan𝝿, dalam setiap ikatan tripel terdapat 1 ikatan 𝞂 dan 2 ikatan 𝝿.
Jawaban yang tepat adalah B. 4
Soal Nomor 13 OSP Kimia 2017
Suatu kristal senyawa logam fluorida, ion-ion fluorida menempati posisi kisi kubus di setiap sudut (pojok) dan pada bagian muka, sedangkan 4 atom logam menempati posisi di dalam badan kubus dari sel satuan kristalnya. Rumus molekul logam fluorida tersebut adalah
A. MF
B. MF2
C. MF3
D. M4F14
E. MF8
Pembahasan Soal Nomor 13 OSP Kimia 2017
F menempati setiap pojok. Jumlah pojok pada kubus sebanyak 8. Satu atom di pojok akan masuk dalam satuan kisi hanya 1/8 saja. Jadi total atom dipojok =1/8 bagian atom × 8 = 1 atom F
F menempati muka kubus, muka kubus ada 6, setiap atom pada muka kubus akan masuk ke dalam satuan kisi hanya ½. Jadi total atom di muka kubus = ½ × 6 = 3 atom F.
Total atom F = 4,
Logam M dalam satuan kisi ada 4, jadi rumusnya M4F4 atau MF.
Jawaban yang tepat adalah A. MF.
Soal Nomor 14 OSP Kimia 2017
Reaksi (CH3)3CCl dalam larutan basa sesuai dengan persamaan berikut:
(CH3)3CCl + OH– → (CH3)3COH + Cl–
Mekanisme reaksi yang disepakati untuk reaksi tersebut adalah:
(CH3)3CCl → (CH3)3C+ + Cl– (lambat)
(CH3)3C+ + OH– → (CH3)3COH (cepat)
Pernyataan hukum laju yang paling tepat untuk reaksi tersebut adalah
A. laju = k[Cl–]
B. laju = k[(CH3)3CCl]
C. laju = k[(CH3)3C+]
D. laju = k[(CH3)3C+] [OH–]
E. laju = k[(CH3)3CCl] [OH–]
Pembahasan Soal Nomor 14 OSP Kimia 2017
Laju reaksi untuk reaksi keseluruhan hanya ditentukan oleh tahap lambat saja. Karena pada tahap lambat hanya terdapat 1 molekul (CH3)3CCl maka rumus laju reaksinya = k[(CH3)3CCl]
Jawaban yang tepat adalah B. laju = k[(CH3)3CCl]
Soal Nomor 16 OSP Kimia 2017
Anda mempunyai dua jenis larutan peyangga (buffer), yaitu larutan penyangga “A” dan larutan penyangga “B” yang dibuat dengan menggunakan asam propanoat dan kasium propanoat (yang biasa diggunakan sebagai pengawet makan). Jika larutan penyangga “A” mengandung 0,10 M asam dan garamnya, sedangkan larutan penyangga “B” mengandung 0,20 M asam dan garamnya, maka pernyataan di bawah ini yang paling tepat adalah
A. Kedua larutan penyangga akan mempunyai pH yang sama dan kapasitas buffer yang sama
B. Larutan “B” akan mempunyai pH lebih tinggi dan kapasitas buffer lebih besar
C. Larutan “B” akan mempunyai pH lebih rendah dan keduanya mempunyai kapasitas buffer yang sama
D. Larutan “B” akan mempunyai pH lebih rendah dan kapasitas buffer lebih besar
E. Kedua larutan akan mempunyai pH yang sama, dan larutan “B” mempunyai kapasitas buffer lebih besar.
Pembahasan Soal Nomor 16 OSP Kimia 2017
Bila suatu campuran yang membentuk larutan penyangga memiliki jumlah asam lemah dan jumlah garam yang sama pH-nya akan setara dengan pKa. Larutan Penyangga A dan B memiliki perbandingan asam dan garam sama yaitu 1 : 1, maka keduanya memiliki pH sama pula. Pada opsi yang tersedia pH sama hanya E, maka pilihan yang tepat dapat ditebak. Bagaimana dengan kapasitas buffer? Walau memiliki perbandingan yang sama namun jumlah asam/basa keduanya berbeda. jumlah asam dan garam yang lebih besar akan memiliki kapasitas buffer lebih besar, ia dapat “mengkounter” penambahan asam/basa jauh lebih banyak.
Jawaban yang tepat adalah E.
Soal Nomor 17 OSP Kimia 2017
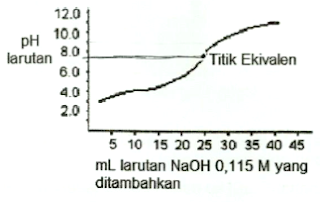
Sebanyak 25,0 mL larutan asam monoprotik dititrasi dengan 0,115 M NaOH dan diperoleh kurva titrasi di bawah ini.
Di antara indikator berikut yang paling tepat untuk titrasi ini adalah
A. Metil jingga; pKa = 3,46
B. Metil merah; pKa = 5,00
C. Bromokresol ungu; pKa = 6,12
D. Bromotimol biru; pKa = 7,10
E. Fenolftalein pKa = 9,10
Pembahasan Soal Nomor 17 OSP Kimia 2017
Titik ekuivalen adalah titik ketika jumlah asam setara dengan jumlah NaOH. Dari soal dan kurva dapat diketahui bahwa pH ketika titik ekuvalen sekitar 7 lebih sedikit, volume NaOH 0,115 M sekitar 25 mL . Volume asam monoprotik sebut saja HA juga 25 mL. Bila lebih dari 7 lebih sedikit itu diharapkan larutan indikator akan menunjukkan perubahan warna sehingga bisa jadi petunjuk bahwa titik ekuivalen tercapai.
Dari alternatif jawaban yang tersedia bromotimol biru dengan pKa = 7,10 adalah yang paling tepat. Karena secara ideal pada titik ekivalen itu nilai pH = pKa dari indikator.
Jawaban yang tepat adalah D
Soal Nomor 18 OSP Kimia 2017
Di antara senyawa berikut yang mempunyai kelarutan molar paling besar dalam air adalah
A. CdCO3; Ksp = 5,2×10–12
B. Cd(OH)2; Ksp = 5,9×10–15
C. CaF2; Ksp = 4,0×10–11
D. AgI; Ksp = 8,3×10–17
E. ZnCO3; Ksp = 2,0×10–10
Pembahasan Soal Nomor 18 OSP Kimia 2017
Soal seperti ini biasa dengan mudah membandingkan kelarutan (s) hanya dengan membagi pangkat dari 10 dengan jumlah ion. Bila diperoleh angka yang sama sila periksa angka pengali dari 10n. Pangkat negatif terkecil berarti nilai kelarutannya terbesar.
Jawaban yang tepat adalah C. CaF2
Soal Nomor 19 OSP Kimia 2017
Arus listrik 0,0965 A dialirkan ke dalam 50 mL larutan NaCl 0,1 M selama 1000 detik, maka konsentrasi OH– dalam larutan adalah
A. 0,0005 M
B. 0,0010 M
C. 0,0020 M
D. 0,0100 M
E. 0,0200 M
Pembahasan Soal Nomor 19 OSP Kimia 2017
Untuk adalah elektrolisis larutan NaCl.
Reaksi yang terjadi:
Reduksi : 2H2O + 2e– → H2 + 2OH–
Oksidasi : 2Cl– → Cl2 + 2e–
Jumlah elektron (satuan mol) = (i × t)/96500 mol = (0,0965 × 1000)/96500 = 0,001 mol
Jumlah OH– (satuan mol) = jumlah elektron (satuan mol)
Jumlah OH– (satuan mol) = 0,001 mol
[OH–] = 0,001 mol/0,05 L= 0,02 M
Jawaban yang tepat adalah E. 0,0200 M
Soal Nomor 20 OSP Kimia 2017
Gambar berikut adalah suatu sel Volta dengan elektroda magnesium yang dicelupkan ke dalam larutan magnesium klorida (MgCl2) dan elektroda perak (Ag) yang dicelupkan ke dalam larutan perak nitrat, AgNO3.
Kedua setengah sel dihubungkan oleh jembatan garam. Cara yang paling tepat untuk menambah potensial sel adalah
A. penambahan NaCl ke dalam kedua setengah sel
B. menaikkan konsentrasi Mg2+ dan menurunkan konsentrasi Ag+
C. menambah ukuran elektroda Mg dan mengurangi ukuran elektroda Ag
D. mengurangi ukuran elektroda Mg dan menambah ukuran elektroda Ag
E. menurunkan konsentrasi Mg2+
Pembahasan Soal Nomor 20 OSP Kimia 2017
Konsep potensial sel untuk sel volta adalah hukum Nernst.
Semakin besar temperatur, semakin kecil muatan, semakin besar Qc maka potensial sel bertambah juga. Pada alternatif jawaban hanya memandang faktor konsentrasi, dalam hal ini terkait Qc, Qc akan semakin besar bila konsentrasi hasil reaksi semakin besar atau dengan menurunkan konsentrasi pereaksi.
Dalam reaksi tersebut Mg(s) + Ag+ → Ag(s) + Mg2+.
Jadi alternatif yang tepat adalah B, menaikkan konsentrasi Mg2+ dan menurunkan konsentrasi Ag+
Soal Nomor 22 OSP Kimia 2017
Suatu senyawa tak dikenal ditemukan dan memiliki rumus molekul C10H20O2. Di antara kelompok senyawa berikut yang bukan merupakan kelompok yang mungkin dimiliki oleh senyawa ini adalah
A. alkuna
B. alkena
C. alkohol
D. ester
E. eter
Pembahasan Soal Nomor 22 OSP Kimia 2017
Pada soal ini ada istilah asing bagi pebelajar kimia, kata “kelompok”. menurut dugaan penulis maksudnya mungkin gugus fungsi yang selama ini kita gunakan dalam pemelajaran kimia organik. Dari kalimat di atas dapat di ubah menjadi “Di antara gugus fungsi berikut yang bukan merupakan gugus fungsi yang mungkin dimiliki oleh senyawa ini adalah....”
Ester, jelas merupakan gugus fungsi yang sangat mungkin pada senyawa tersebut, ingat rumus umum eter adalah CnH2nO2. Alkohol, juga mungkin karena bisa jadi dalam membentuk 2 gugus hidroksil. Eter juga sangat mungkin, demikian pula dengan alkena sangat mungkin terkandung dalam molekul yang memiliki rumus C10H20O2.
Akuna seperti pada contoh struktur di bawah ini jumlah H menjadi tidak sama dengan 20.
Soal Nomor 21 OSP Kimia 2017
Nilai tetapan kesetimbangan untuk reaksi berikut ini pada 298 K adalah
2Ag+(aq) + 2I– (aq) → I2(s) + 2Ag(s) E0 = + 0,265 V
A. 87,90
B. 7,73 × 103
C. 2,99 × 104
D. 1,60 × 107
E. 9,21 × 108
Pembahasan Soal Nomor 21 OSP Kimia 2017
2Ag+(aq) + 2e–→ 2Ag(s)
2I– (aq) → I2(s) + 2e–
E0 = (RT/nF) ln K ; n = transfer elektron yang terlibat; K = tetapan kesetimbangan
→ ln K = E0/(RT/nF)
→ ln K = 0,265 V/((8,3145 J/mol.K × 298 K)/(2 mol × 96500 J/V.mol e–)
→ ln K = 20,64
→ K = e20,64
→ K = 9,21×108
Jawaban yang tepat adalah E. 9,21×108
Soal Nomor 23 OSP Kimia 2017
Nama senyawa berikut yang paling sesuai dengan konvensi tata nama resmi IUPAC adalah
A. 3,3-dikloro-5-propilheptana
B. 3,3-dikloro-5-etilheptana
C. 5,5-dikloro-3-propilheptana
D. 6,6-dikloro-4-etiloktana
E. 3,3-dikloro-5-etiloktana
Pembahasan Soal Nomor 23 OSP Kimia 2017
Jawaban yang tepat adalah E. 3,3‐dikloro‐5‐etiloktan
Soal Nomor 25 OSP Kimia 2017
Pasangan senyawa golongan ester dan amina adalah
A. CH3COOH dan CH3CONH2
B. CH3CH2OH dan CH3COONH2
C. CH3CH2COOCH3 dan CH3CH2NH2
D. CH3COCH3 dan CH3NH2
E. CH3OCH3 dan CH3CONH2
Pembahasan Soal Nomor 25 OSP Kimia 2017
Ester memiliki rumus umum R-COOR dan amina memiliki rumus umum R-NH2 atau R2NH atau R3N, R adalah alkil atau aril.
Jawaban yang tepat adalah C. CH3CH2COOCH3 dan CH3CH2NH2
Soal Nomor 1 OSP Kimia 2017
Larutan pekat asam klorida HCl adalah larutan 36% w/w HCl dalam air. Larutan ini memiliki rapat massa 1,18 g/cm3. Konsentrasi larutan tersebut adalah
A. 1,16 M
B. 9,87 M
C. 11,65 M
D. 19,70 M
E. 23,30 M
Pembahasan Soal Nomor 1 OSP Kimia 2017
Kadar HCl pekat 36% berat/berat, rapat massa atau massa jenis 1,18 g/cm3, bila 1000 cm3 (1000 mL atau 1 L ) ini setara HCl sebanyak 1180 g.
Massa molar HCl dari data tabel periodik yang diberikan = 35,45 + 1,008 = 36,458 g/mol
Di misalkan terdapat 1 L = 1180 g × 36% = 424,8 g
Jumlah HCl = 424,8 g : 36,458 g/mol = 11,65175 M
Jawaban yang tepat adalah C. 11,65 M
Soal Nomor 2 OSP Kimia 2017
Suatu reaksi kimia dapat disebut sebagai suatu reaksi redoks jika:
(1) Mengalami perubahan bilangan oksidasi yang lebih tinggi dari semula
(2) Kehilangan elektron
(3) Menerima proton
(4) Bersenyawa dengan oksigen
(5) Berubah menjadi fasa gas
Jawaban yang paling tepat adalah
A. 1, 2, 3
B. 1, 2, 4
C. 1, 3, 5
D. 1, 3, 4
E. 2, 4, 5
Pembahasan Soal Nomor 2 OSP Kimia 2017
Konsep reaksi redoks dapat ditinjau berdasar:
· Ada-tidaknya perubahan bilangan oksidasi
· Lepas-terima elektron
· Lepas-terima oksigen
· Lepas-terima hidrogen
Jawaban yang tepat adalah B
Di antara kombinasi pasangan yang tepat adalah 1, 2, 4.
Soal Nomor 3 OSP Kimia 2017
Dari reaksi-reaksi berikut:
(1) Cl2 + IO3– + 2OH– → IO4– + 2Cl– + H2O
(2) Cl2 + 2OH– → ClO– + Cl– + H2O
(3) 3ClO– → ClO3– + 2Cl–
(4) H2 + Cl2 → 2HCl
Yang merupakan reaksi disproporsionasi (auto oksidasi-reduksi) adalah
A. 1, 2, 3
B. 2, 4
C. 2, 3
D. 3, 4
E. 1, 3, 4
Pembahasan Soal Nomor 3 OSP Kimia 2017
Ciri kasad mata reaksi disproporsionasi adalah adanya 1 macam spesi di ruas kiri kemudian berubah menjadi 2 macam spesi, dan terdapat perubahan bilangan oksidasi meningkat bila dipasangkan dengan 1 spesi di ruas kanan, serta terdapat perubahan bilangan oksidasi menurun bila dipasangan dengan 1 spesi lainnya di ruas kanan juga.
Jawaban yang tepat adalah C. 2 dan 3.
Soal Nomor 4 OSP Kimia 2017
Molalitas senyawa para-diklorobenzena (C6H4Cl2) dalam suatu larutan yang dibuat dengan cara melarutkan 2,65 g C6H4Cl2 dalam 50 mL benzena (kerapatan = 0,879 g/mL) adalah
A. 0,018 m
B. 0,041 m
C. 0,180 m
D. 0,410 m
E. 1,810 m
Pembahasan Soal Nomor 4 OSP Kimia 2017
1 molal = 1 mol zat terlarut dalam setiap 1 kg pelarut = 1 mol/kg
Massa C6H4Cl2 = 2,65 g; Massa molar C6H4Cl2 = (6×12,01+4×1,008+2×35,45) = 146,992 g/mol
Jumlah C6H4Cl2 = 2,65 g : 146,992 g/mol = 0,018028 mol
Massa pelarut benzena 50 mL × 0,879 g/mL = 43,95 g = 0,04395 kg
Molalitas = 0,018028 mol : 0,04395 kg = 0,410198 mol/kg = 0,41 molal
Jawaban yang tepat adalah D. 0,41 molal
Soal Nomor 5 OSP Kimia 2017
Sebanyak 10 g parafin, C20H42 , suatu zat terlarut yang tak mudah menguap, dilarutkan dalam 50 g benzena, C6H6. Pada suhu 53 oC, tekanan uap murni benzena adalah 300 torr. Tekanan uap larutan pada suhu tersebut adalah
A. 298 torr
B. 292 torr
C. 284 torr
D. 275 torr
E. 267 torr
Pembahasan Soal Nomor 5 OSP Kimia 2017
10 g C20H42 = 10 g : 282,536 g/mol = 0,035394 mol
50 g C6H6 = 50 g : 78.108 g/mol = 0,640139 mol
Fraksi mol C20H42 dalam benzena = 0,035394 mol : (0,035394 + 0,640139) mol = 0,052394
∆P = Fraksi mol C20H42 dalam benzena × Po Benzena
∆P = 0,052394 × 300 torr
∆P = 15,71825 torr
Tekanan uap larutan = Po – ∆P
Tekanan uap larutan = (300 – 15,71825) torr
Tekanan uap larutan = 284.2818 torr ≈ 284 torr
Jawaban yang tepat adalah C. 284 torr
Soal Nomor 6 OSP Kimia 2017
Kreatinin adalah produk samping dari metabolisme nitrogen yang dapat digunakan untuk indikasi fungsi renal. Sebanyak 4,04 g sampel kreatinin dilarutkan dalam air menghasilkan 100 mL larutan dengan tekanan osmosis sebesar 8,73 mmHg pada 25 oC. Massa molekul kreatinin adalah
A. 4,3 × 105 g/mol
B. 8,6 × 105 g/mol
C. 4,3 × 104 g/mol
D. 8,6 × 104 g/mol
E. 1,3 × 103 g/mol
Pembahasan Soal Nomor 6 OSP Kimia 2017
Bahasan Sifat Koligatif Larutan
Tekanan osmosis larutan (p)
p = MRT → p = (nRT)/V
R = 0,08205 L.atm/mol.K
T = (25 + 273) K = 298 K
V = 100 mL = 0,1 L
p = 8,73 mmHg : 760 mmHg/atm = 0,011487 atm
→ p = (massa zat/massa molar zat)RT / V
→ massa molar zat = (massa zat × R × T)/(p.V)
→ massa molar zat = (4,04 g × 0,08205 L.atm/mol.K × 298 K) : (0.011487 atm × 0,1 L)
→ massa molar zat = 85995,47 g/mol ≈ 8,6 × 104 g/mol
Jawaban yang tepat adalah D. 8,6 × 104 g/mol
Soal Nomor 7 OSP Kimia 2017
Sampel senyawa dengan berat 7,85 g memiliki rumus empiris C5H4, dilarutkan dalam 301 g benzena. Titik beku larutan ini 1,05 oC di bawah titik beku benzena murni. (diketahui Kf benzena = 5,12 oC/m). Rumus molekul senyawa ini adalah
A. C5H4
B. C10H8
C. C15H12
D. C20H1
E. C25H20
Pembahasan Soal Nomor 7 OSP Kimia 2017
Bahasan Sifat Koligatif Larutan
∆Tf = m × Kf
1,05 = m × 5,12 oC/m
m = 1,05 : 5,12 oC/m
m = 0,205078 molal
m = n/(kg pelarut)
n = m × kg pelarut
n = 0,205078 molal × 0,301 kg
n = 0,061729 mol
massa molar zat = massa zat : n zat
(C5H4)x = 7,85 g : 0,061729 mol
(C5H4)x = 127.1698 g/mol
64,082 g/mol x = 127,1698 g/mol
x = 127,1696 : 64,082
x = 1.984485
x ≈ 2
Rumus molekul zat tersebut = (C5H4)2 = C10H8
Jawaban yang tepat adalah B. C10H8
Soal Nomor 8 OSP Kimia 2017
Suatu larutan metanol 60% dalam air membentuk sistem azeotrop, sehingga ketika dilakukan distilasi sederhana tidak akan memisah dengan sempurna. Di antara pernyataan berikut:
(1) ∆Hpelarutan metanol-air < 0 (eksoterm)
(2) Larutan metanol-air mengalami penyimpangan positif hukum Raoult
(3) Interaksi metanol-air > interaksi metanol-metanol; interaksi air-air
(4) ∆Vpelarutan metanol-air > 0 (endoterm)
Yang dapat menjelaskan fenomena di atas adalah
A. 1, 2, dan 3
B. 1 dan 3
C. 2 dan 4
D. 1
E. 4
Pembahasan Soal Nomor 8 OSP Kimia 2017
Jawaban yang tepat adalah A
Soal Nomor 9 OSP Kimia 2017
Di antara molekul berikut ini

Yang mempunyai struktur (struktur-struktur) titik Lewis yang benar adalah
A. 1, 2, dan 3
B. Hanya 1 dan 2
C. Hanya 2 dan 3
D. Hanya 2
E. Hanya 3
Pembahasan Soal Nomor 9 OSP Kimia 2017
Atom pusat suatu molekul yang dalam sistem periodik berada pada periode 2 biasanya akan stabil bila memiliki 8 elektron yang mengitarinya.
Atom pusat yang dalam sistem periodik unsur berada pada periode 3 atau lebih tinggi seperti S, P, Cl, Br, I, bisa saja (boleh) tidak mengikuti kaidah oktet, atau sering disebut dengan mengikuti kaidah oktet yang diperluas, boleh lebih dari 8 elektron yang berada di sekitarnya.
Molekul pertama dan kedua sudah benar dengan alasan di atas, molekul ketiga tidak benar karena N hanya sanggup menampung 8 elektron atau kurang tetapi tidak akan lebih. Pada molekul ketiga N “memiliki” 10 elektron yang ada di sekitarnya.
Jawaban yang tepat adalah B. Hanya 1 dan 2.
Soal Nomor 10 OSP Kimia 2017
Metilbenzoat, disebut juga “minyak Niobe”, digunkan dalam parfum (minyak-wangi), memiliki struktur berikut.
Hibridisasi atom karbon 1, 2 dan 3 dalam struktur minyak Niobe di atas berturut-turut adalah
A. sp, sp, sp2
B. sp, sp2, sp3
C. sp2, sp2, sp3
D. sp2, sp2, sp2
E. sp, sp, sp3
Pembahasan Soal Nomor 10 OSP Kimia 2017
Atom C yang hanya mempunyai ikatan singel saja, hibridisasinya adalah sp3
Atom C yang hanya mempunyai sebuah ikatan dobel, hibridisasinya adalah sp2
Atom C yang hanya mempunyai ikatan tripel, hibridisasinya adalah sp
Jawaban yang tepat adalah C. sp2, sp2, sp3
Soal Nomor 11 OSP Kimia 2017
Dalam pembakaran sempurna gas asetilena, C2H2, perubahan hibridisasi yang dapat terjadi pada atom karbon (bila ada) adalah
A. sp3 ke sp
B. sp2 ke sp3
C. sp2 ke sp
D. sp ke sp3
E. sp ke sp
Pembahasan Soal Nomor 11 OSP Kimia 2017
Reaksi kimia: C2H2 + 3/2 O2 → 2CO2 + H2O
Atom C yang hanya mempunyai ikatan singel saja, hibridisasinya adalah sp3
Atom C yang hanya mempunyai sebuah ikatan dobel, hibridisasinya adalah sp2
Atom C yang hanya mempunyai ikatan tripel atau 2 ikatan dobel, hibridisasinya adalah sp
Jawaban yang tepat adalah E. sp ke sp
Soal Nomor 12 OSP Kimia 2017
Jumlah ikatan pi (𝝅) yang terdapat dalam molekul berikut ini adalah
A. 2
B. 4
C. 6
D. 7
E. 10
Pembahasan Soal Nomor 12 OSP Kimia 2017
Dalam setiap ikatan singel hanya terdapat 1 ikatan 𝞂, dalam setiap ikatan dobel terdapat 1 ikatan 𝞂 dan 1 ikatan𝝿, dalam setiap ikatan tripel terdapat 1 ikatan 𝞂 dan 2 ikatan 𝝿.
Jawaban yang tepat adalah B. 4
Soal Nomor 13 OSP Kimia 2017
Suatu kristal senyawa logam fluorida, ion-ion fluorida menempati posisi kisi kubus di setiap sudut (pojok) dan pada bagian muka, sedangkan 4 atom logam menempati posisi di dalam badan kubus dari sel satuan kristalnya. Rumus molekul logam fluorida tersebut adalah
A. MF
B. MF2
C. MF3
D. M4F14
E. MF8
Pembahasan Soal Nomor 13 OSP Kimia 2017
F menempati setiap pojok. Jumlah pojok pada kubus sebanyak 8. Satu atom di pojok akan masuk dalam satuan kisi hanya 1/8 saja. Jadi total atom dipojok =1/8 bagian atom × 8 = 1 atom F
F menempati muka kubus, muka kubus ada 6, setiap atom pada muka kubus akan masuk ke dalam satuan kisi hanya ½. Jadi total atom di muka kubus = ½ × 6 = 3 atom F.
Total atom F = 4,
Logam M dalam satuan kisi ada 4, jadi rumusnya M4F4 atau MF.
Jawaban yang tepat adalah A. MF.
Soal Nomor 14 OSP Kimia 2017
Reaksi (CH3)3CCl dalam larutan basa sesuai dengan persamaan berikut:
(CH3)3CCl + OH– → (CH3)3COH + Cl–
Mekanisme reaksi yang disepakati untuk reaksi tersebut adalah:
(CH3)3CCl → (CH3)3C+ + Cl– (lambat)
(CH3)3C+ + OH– → (CH3)3COH (cepat)
Pernyataan hukum laju yang paling tepat untuk reaksi tersebut adalah
A. laju = k[Cl–]
B. laju = k[(CH3)3CCl]
C. laju = k[(CH3)3C+]
D. laju = k[(CH3)3C+] [OH–]
E. laju = k[(CH3)3CCl] [OH–]
Pembahasan Soal Nomor 14 OSP Kimia 2017
Laju reaksi untuk reaksi keseluruhan hanya ditentukan oleh tahap lambat saja. Karena pada tahap lambat hanya terdapat 1 molekul (CH3)3CCl maka rumus laju reaksinya = k[(CH3)3CCl]
Jawaban yang tepat adalah B. laju = k[(CH3)3CCl]
Soal Nomor 16 OSP Kimia 2017
Anda mempunyai dua jenis larutan peyangga (buffer), yaitu larutan penyangga “A” dan larutan penyangga “B” yang dibuat dengan menggunakan asam propanoat dan kasium propanoat (yang biasa diggunakan sebagai pengawet makan). Jika larutan penyangga “A” mengandung 0,10 M asam dan garamnya, sedangkan larutan penyangga “B” mengandung 0,20 M asam dan garamnya, maka pernyataan di bawah ini yang paling tepat adalah
A. Kedua larutan penyangga akan mempunyai pH yang sama dan kapasitas buffer yang sama
B. Larutan “B” akan mempunyai pH lebih tinggi dan kapasitas buffer lebih besar
C. Larutan “B” akan mempunyai pH lebih rendah dan keduanya mempunyai kapasitas buffer yang sama
D. Larutan “B” akan mempunyai pH lebih rendah dan kapasitas buffer lebih besar
E. Kedua larutan akan mempunyai pH yang sama, dan larutan “B” mempunyai kapasitas buffer lebih besar.
Pembahasan Soal Nomor 16 OSP Kimia 2017
Bila suatu campuran yang membentuk larutan penyangga memiliki jumlah asam lemah dan jumlah garam yang sama pH-nya akan setara dengan pKa. Larutan Penyangga A dan B memiliki perbandingan asam dan garam sama yaitu 1 : 1, maka keduanya memiliki pH sama pula. Pada opsi yang tersedia pH sama hanya E, maka pilihan yang tepat dapat ditebak. Bagaimana dengan kapasitas buffer? Walau memiliki perbandingan yang sama namun jumlah asam/basa keduanya berbeda. jumlah asam dan garam yang lebih besar akan memiliki kapasitas buffer lebih besar, ia dapat “mengkounter” penambahan asam/basa jauh lebih banyak.
Jawaban yang tepat adalah E.
Soal Nomor 17 OSP Kimia 2017
Sebanyak 25,0 mL larutan asam monoprotik dititrasi dengan 0,115 M NaOH dan diperoleh kurva titrasi di bawah ini.
Di antara indikator berikut yang paling tepat untuk titrasi ini adalah
A. Metil jingga; pKa = 3,46
B. Metil merah; pKa = 5,00
C. Bromokresol ungu; pKa = 6,12
D. Bromotimol biru; pKa = 7,10
E. Fenolftalein pKa = 9,10
Pembahasan Soal Nomor 17 OSP Kimia 2017
Titik ekuivalen adalah titik ketika jumlah asam setara dengan jumlah NaOH. Dari soal dan kurva dapat diketahui bahwa pH ketika titik ekuvalen sekitar 7 lebih sedikit, volume NaOH 0,115 M sekitar 25 mL . Volume asam monoprotik sebut saja HA juga 25 mL. Bila lebih dari 7 lebih sedikit itu diharapkan larutan indikator akan menunjukkan perubahan warna sehingga bisa jadi petunjuk bahwa titik ekuivalen tercapai.
Dari alternatif jawaban yang tersedia bromotimol biru dengan pKa = 7,10 adalah yang paling tepat. Karena secara ideal pada titik ekivalen itu nilai pH = pKa dari indikator.
Jawaban yang tepat adalah D
Soal Nomor 18 OSP Kimia 2017
Di antara senyawa berikut yang mempunyai kelarutan molar paling besar dalam air adalah
A. CdCO3; Ksp = 5,2×10–12
B. Cd(OH)2; Ksp = 5,9×10–15
C. CaF2; Ksp = 4,0×10–11
D. AgI; Ksp = 8,3×10–17
E. ZnCO3; Ksp = 2,0×10–10
Pembahasan Soal Nomor 18 OSP Kimia 2017
Soal seperti ini biasa dengan mudah membandingkan kelarutan (s) hanya dengan membagi pangkat dari 10 dengan jumlah ion. Bila diperoleh angka yang sama sila periksa angka pengali dari 10n. Pangkat negatif terkecil berarti nilai kelarutannya terbesar.
| Senyawa | Jumlah ion | Ksp | Perkiraan s |
| CdCO3 | 2 | 5,2×10–12 | 10–12/2 = 10–5 |
| Cd(OH)2 | 3 | 5,9×10–15 | 10–15/3 = 10–5 |
| CaF2 | 3 | 4,0×10–11 | 10–11/3 = 10–3,67 |
| AgI | 2 | 8,3×10–17 | 10–17/2 = 10–8,5 |
| ZnCO3 | 2 | 2,0×10–10 | 10–10/2 = 10–5 |
Soal Nomor 19 OSP Kimia 2017
Arus listrik 0,0965 A dialirkan ke dalam 50 mL larutan NaCl 0,1 M selama 1000 detik, maka konsentrasi OH– dalam larutan adalah
A. 0,0005 M
B. 0,0010 M
C. 0,0020 M
D. 0,0100 M
E. 0,0200 M
Pembahasan Soal Nomor 19 OSP Kimia 2017
Untuk adalah elektrolisis larutan NaCl.
Reaksi yang terjadi:
Reduksi : 2H2O + 2e– → H2 + 2OH–
Oksidasi : 2Cl– → Cl2 + 2e–
Jumlah elektron (satuan mol) = (i × t)/96500 mol = (0,0965 × 1000)/96500 = 0,001 mol
Jumlah OH– (satuan mol) = jumlah elektron (satuan mol)
Jumlah OH– (satuan mol) = 0,001 mol
[OH–] = 0,001 mol/0,05 L= 0,02 M
Jawaban yang tepat adalah E. 0,0200 M
Soal Nomor 20 OSP Kimia 2017
Gambar berikut adalah suatu sel Volta dengan elektroda magnesium yang dicelupkan ke dalam larutan magnesium klorida (MgCl2) dan elektroda perak (Ag) yang dicelupkan ke dalam larutan perak nitrat, AgNO3.
Kedua setengah sel dihubungkan oleh jembatan garam. Cara yang paling tepat untuk menambah potensial sel adalah
A. penambahan NaCl ke dalam kedua setengah sel
B. menaikkan konsentrasi Mg2+ dan menurunkan konsentrasi Ag+
C. menambah ukuran elektroda Mg dan mengurangi ukuran elektroda Ag
D. mengurangi ukuran elektroda Mg dan menambah ukuran elektroda Ag
E. menurunkan konsentrasi Mg2+
Pembahasan Soal Nomor 20 OSP Kimia 2017
Konsep potensial sel untuk sel volta adalah hukum Nernst.
Semakin besar temperatur, semakin kecil muatan, semakin besar Qc maka potensial sel bertambah juga. Pada alternatif jawaban hanya memandang faktor konsentrasi, dalam hal ini terkait Qc, Qc akan semakin besar bila konsentrasi hasil reaksi semakin besar atau dengan menurunkan konsentrasi pereaksi.
Dalam reaksi tersebut Mg(s) + Ag+ → Ag(s) + Mg2+.
Jadi alternatif yang tepat adalah B, menaikkan konsentrasi Mg2+ dan menurunkan konsentrasi Ag+
Soal Nomor 22 OSP Kimia 2017
Suatu senyawa tak dikenal ditemukan dan memiliki rumus molekul C10H20O2. Di antara kelompok senyawa berikut yang bukan merupakan kelompok yang mungkin dimiliki oleh senyawa ini adalah
A. alkuna
B. alkena
C. alkohol
D. ester
E. eter
Pembahasan Soal Nomor 22 OSP Kimia 2017
Pada soal ini ada istilah asing bagi pebelajar kimia, kata “kelompok”. menurut dugaan penulis maksudnya mungkin gugus fungsi yang selama ini kita gunakan dalam pemelajaran kimia organik. Dari kalimat di atas dapat di ubah menjadi “Di antara gugus fungsi berikut yang bukan merupakan gugus fungsi yang mungkin dimiliki oleh senyawa ini adalah....”
Ester, jelas merupakan gugus fungsi yang sangat mungkin pada senyawa tersebut, ingat rumus umum eter adalah CnH2nO2. Alkohol, juga mungkin karena bisa jadi dalam membentuk 2 gugus hidroksil. Eter juga sangat mungkin, demikian pula dengan alkena sangat mungkin terkandung dalam molekul yang memiliki rumus C10H20O2.
Akuna seperti pada contoh struktur di bawah ini jumlah H menjadi tidak sama dengan 20.
Soal Nomor 21 OSP Kimia 2017
Nilai tetapan kesetimbangan untuk reaksi berikut ini pada 298 K adalah
2Ag+(aq) + 2I– (aq) → I2(s) + 2Ag(s) E0 = + 0,265 V
A. 87,90
B. 7,73 × 103
C. 2,99 × 104
D. 1,60 × 107
E. 9,21 × 108
Pembahasan Soal Nomor 21 OSP Kimia 2017
2Ag+(aq) + 2e–→ 2Ag(s)
2I– (aq) → I2(s) + 2e–
E0 = (RT/nF) ln K ; n = transfer elektron yang terlibat; K = tetapan kesetimbangan
→ ln K = E0/(RT/nF)
→ ln K = 0,265 V/((8,3145 J/mol.K × 298 K)/(2 mol × 96500 J/V.mol e–)
→ ln K = 20,64
→ K = e20,64
→ K = 9,21×108
Jawaban yang tepat adalah E. 9,21×108
Soal Nomor 23 OSP Kimia 2017
Nama senyawa berikut yang paling sesuai dengan konvensi tata nama resmi IUPAC adalah
A. 3,3-dikloro-5-propilheptana
B. 3,3-dikloro-5-etilheptana
C. 5,5-dikloro-3-propilheptana
D. 6,6-dikloro-4-etiloktana
E. 3,3-dikloro-5-etiloktana
Pembahasan Soal Nomor 23 OSP Kimia 2017
Jawaban yang tepat adalah E. 3,3‐dikloro‐5‐etiloktan
Soal Nomor 25 OSP Kimia 2017
Pasangan senyawa golongan ester dan amina adalah
A. CH3COOH dan CH3CONH2
B. CH3CH2OH dan CH3COONH2
C. CH3CH2COOCH3 dan CH3CH2NH2
D. CH3COCH3 dan CH3NH2
E. CH3OCH3 dan CH3CONH2
Pembahasan Soal Nomor 25 OSP Kimia 2017
Ester memiliki rumus umum R-COOR dan amina memiliki rumus umum R-NH2 atau R2NH atau R3N, R adalah alkil atau aril.
Jawaban yang tepat adalah C. CH3CH2COOCH3 dan CH3CH2NH2











Tidak ada komentar:
Posting Komentar