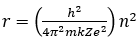Atom Hidrogen adalah atom yang paling sederhana. Dalam sebuah tabung lucutan gas diberi beda potensial yang tinggi, sehingga terjadi lucutan muatan listrik. Gas hidrogen menjadi bercahaya dan memancarkan cahaya merah kebiru-biruan. Cahaya ini dapat dianalisis dengan sebuah spektrograf (alat untuk menyelidiki spektrum). Pada pelat foto kita akan mengamati deretan garis-garis cahaya. Setiap garis menampilkan sebuah panjang gelombang cahaya yang diberikan oleh sumber cahaya.
 |
| Gambar 1: Spektrum atom hidrogen |
Dari semua spektrum yang ada, spektrum pancar gas hideogen yang paling menarik, ditinjau baik dari sejarahnya maupun alasan teori. Spektrum ini terdiri dari sederetan garis-garis seperti pada gambar 1. Tiap garis diberi nama Hα (garis merah), Hβ (biru-hijau), Hγ (biru), dan Hδ (ungu dan ultraungu). Dengan mengutak-atik angka panjang gelombang dari tiap garis spektral, pada tahun 1885 Johann Jakob Balmer mengatakan bahwa panjang gelombang dari garis-garis spektral ini mengikuti suatu aturan yang sangat sederhana. Aturan ini dituliskan dalam bentuk:
b merupakan suatu konstanta yang besarnya 364,56 nm dan n merupakan bilangan bulat yang bergantung pada jenis garis spektral, misalnya n = 3 untuk garis Hα; n = 4 untuk garis Hβ dan seterusnya. (Catatan: Balmer hanya menganalisis empat garis tersebut yang ditemukan pada waktu itu).
Rumus Balmer yang ditulis di atas sering ditulis dalam bentuk yang lebih menarik lagi seperti berikut
Dengan RH menyatakan suatu konstantayang dinamakan konstanta Rydberg,
RH = 4/b = 1,0973732 x 107 m-1
Kalau kita perhatikan dengan seksama persamaan di atas, kita pasti bertanya, mengapa kita pakai 22? Kenapa tidak 12, 32 atau 42? Atau kenapa harus bilangan bulat? Mengapa tidak pecahan?
Pertanyaan di atas juga sudah ditanyakan oleh para fisikawan ketika Balmer menemukan rumus empirisnya (rumus empiris = rumus yang diperoleh dari data hasil percobaan). Balmer pernah berspekulasi bahwa pasti ada deret lain dalam spektrum atom hidrogen atau dalam atom lain. Menurut spekulasi Balmer, deret ini pasti mempunyai aturan sederhana yang mirip dengan deret yang ia temukan, tetapi dengan mengganti 22 menjadi 12, 32 atau 42.
Jika spekulasi Balmer benar, maka rumus Balmer dapat ditulis dalam suatu deret umum:
Untuk deret yang ditemukan Balmer, nf = 2.
Pada tahun 1908 Paschen menemukan 2 garis spektrum hidrogen pada daerah inframerah. Kedua garis masing-masing memenuhi rumus (3) untuk nf = 3 dan ni = 4,5,6,… Deret ini dinamakan deret Paschen. Ternyata spekulasi Balmer tentang adanya deret lain pada hidrogen adalah benar!
Penemuan Paschen ini disusul berturut-turut oleh Lyman, Brackett, dan Pfund. Lyman menemukan deretnya di daerah ultraviolet untuk nf = 1, sedangkan Brackett dan Pfund menemukan deretnya di daerah inframerah untuk nf = 4 dan nf = 5.
Tabel 1 menunjukkan lima deret garis-garis dalam spektrum atom hidrogen
| Nama deret | |||
| Lyman | 1906 – 1914 | Ultraviolet | nf = 1, ni = 2,3,4, … |
| Balmer | 1885 | UV + cahaya tampak | nf = 2, ni = 3,4,5, … |
| Paschen | 1908 | Inframerah | nf = 3, ni = 4,5,6, … |
| Brackett | 1922 | Inframerah | nf = 4, ni = 5,6,7, … |
| Pfund | 1924 | inframerah | nf = 5, ni = 6,7,8, … |
Penemuan deret-deret spektrum gas hidrogen dan penemuan aturan sederhana ini membuat orang mencari apa sesungguhnya yang terjadi dalam gas hidrogen sehingga ia memancarkan spektrum yang rumusnya demikian cantik.