Pada halaman ini akan dibahas mengenai Pembahasan Soal SBMPTN TKD Saintek Kode 471 Bidang Kimia (2018). Semua informasi ini kami rangkum dari berbagai sumber. Semoga memberikan faedah bagi kita semua.
Berikut ini adalah pembahasan soal Kimia pada Soal SBMPTN 2018 TKD Saintek Kode 471 khusus bidang kimia. Pada soal SBMPTN terdapat beberapa perbedaan bila kodenya berbeda. Untuk kode soal lain akan dibahas pada halaman yang berbeda. Silakan koreksi bila ada pembahasan yang kurang tepat. Terima kasih.
Soal #31 SBMPTN-471-2018
Produk oksidasi senyawa berikut adalah ....
Pembahasan Soal #31 SBMPTN 2018
Okisdasi alkohol skunder menghasilkan keton. Jawaban yang tepat adalah C
Jawaban yang tepat C.
Soal #32 SBMPTN-471-2018
Unsur F (nomor atom = 9) dan M (nomor atom = 54) membentuk molekul MF4. Bentuk molekul dan sifat kepolaran molekul MF4 adalah ....
(A) tetrahedral dan nopolar
(B) planar segiempat dan nonpolar
(C) primida dan polar
(D) jungkat-jungkit dan polar
(E) bipiramida segitiga dan polar
Pembahasan Soal #32 SBMPTN 2018
Elektron valensi F = 7 (konfigurasi elektron 1s2 2s2 2p5).
Elektron valensi M = 8 (konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6).
MF4 total jumlah elektron valesi 8+(7×4) = 8+28 = 36,
Jumlah PEI = total ev : 8 = 36/8 = 4, sisa 4.
Jumlah PEB = sisa ev : 2 = 4/2 = 2 PEB
Jadi strukturnya adalah AX4E2 dengan bentuk bujur sangkar atau planar segiempat dan bersifat nonpolar karena posisi PEB berada pada posisi yang saling meniadakan kekuatan tarikan elektron.
Jawaban yang tepat B.
Soal #33 SBMPTN-471-2018
Persentase massa atom Ti (Ar = 48) dalam suatu mineral anorganik adalah 36%.
Jika tetapan Avogadro = 6,0 × 1023 , jumlah atom Ti yang terdapat dalam 4,0 g mineral tersebut adalah ....
(A) 6,0 × 1021
(B) 1,2 × 1022
(C) 1,8 × 1022
(D) 2,4 × 1022
(E) 3,0 × 1022
Pembahasan Soal #33 SBMPTN 2018
Ti dalam mineral = 36% × 4 g = 1,44 gram
Jumlah Ti 1,44 g : 48 g/mol = 0,03 mol
Jumlah partikel = 0,03 mol × 6 .1023 = 1,8 × 1022
Jawaban yang tepat C.
Soal #34 SBMPTN-471-2018
Reaksi berikut terjadi pada 1600 oC.
2B2O3 + 7C → B4C + 6CO
Dalam suatu reaksi, digunakan 14,0 g B2O3 (Mr = 70) dan 9,6 g C (Ar = 12). Jika reaksi memberikan persentase hasil sebesar 80%, massa B4C (Mr = 56) yang diperoleh adalah .....
(A) 11,20 g
(B) 5,60 g
(C) 4,48 g
(D) 2,24 g
(E) 1,12 g
Pembahasan Soal #34 SBMPTN 2018
14,0 g B2O3 = 14,0 g : 70 g/mol = 0,2 mol
9,6 g C = 9,6 g : 12 g/mol = 0,8 mol
Bila yang dihasilkan 100 produk maka massanya adalah 0,1 mol x 56 g/mol = 5,6 g B4C.
Karena persentase hasil hanya 80% maka massa B4C = 80% × 5,6 gram = 4,48 g.
Jawaban yang tepat C.
Soal #35 SBMPTN-471-2018
Gas metanol dapat dibuat dengan mereaksikan gas karbon monoksida dan gas hidrogen menurut reaksi berikut.
CO(g) + 2H2(g) → CH3OH(g)
Gas hasil reaksi tersebut pada V dan T tetap memberikan tekanan 6 atm. Jika kedua pereaksi habis bereaksi, tekanan total gas sebelum reaksi adalah .....
(A) 6 atm
(B) 12 atm
(C) 18 atm
(D) 24 atm
(E) 30 atm
Pembahasan Soal #35 SBMPTN 2018
Pada reaksi gas-gas volume sebanding dengan koefisien atau jumlah zat-zat yang terdapat dalam keadaan
Jawaban yang tepat C.
Soal #36 SBMPTN-471-2018
Data nilai energi ikatan rata-rata diket sebagai berikut.
Jika entalpi reaksi : C2H5F(g) + 2F2(g) → C2H3F3 (g) + 2HF (g)
Nilai entalpi reaksi di atas adalah ....
(A) –481 kJ mol–1
(B) +481 kJ mol–1
(C) –962 kJ mol–1
(D) +962 kJ mol–1
(E) +1443 kJ mol–1
Pembahasan Soal #36 SBMPTN 2018
Jawaban yang tepat C.
Soal #37 SBMPTN-471-2018
Dalam pelarut HF , reaksi disproporsionasi iodium (I2) berlangsung sebagai berikut.
3I2 + 5AgF → 5AgI + IF5
Jumlah mol elektron yang terlibat pada reaksi disproporsionasi 0,3 mol iodium adalah ....
(A) 0,1 mol
(B) 0,2 mol
(C) 0,3 mol
(D) 0,4 mol
(E) 0,5 mol
Pembahasan Soal #37 SBMPTN 2018
Reaksi redoks yang terjadi:
Reduksi: I2 + 2e– → 2I–
Oksidasi: I2 → 2I5+ + 10e10e–
Reduksi: 5I2 + 10e– → 10I–
Oksidasi: I2 → 2I5+ + 10e–
Total: 6I2 + 10e– → 10I– + 2I5+ + 10e–
Total disederhanakan: 3I2 + 5e– → 5I– + I5+ + 5e–
Reaksi bersih: 3I2 → 5I– + I5+
Elektron yang terlibat (transfer elektron yang terjadi) sebanyak 5 elektron. Jumlah mol zat dan jumlah mol elektron akan sebanding dengan koefisien masing-masing.
Jumlah mol elektron yang terlibat : jumlah mol I2 = koefisien elektron yang terlibat : Koefisien Cl2
Jumlah mol elektron yang terlibat : 0,3 mol = 5 : 3
Jumlah mol elektron yang terlibat = 5/3 × 0,3 mol
Jumlah mol elektron yang terlibat = 0,5 mol
Jawaban yang tepat E.
Soal #38 SBMPTN-471-2018
Berikut ini adalah data potensial reduksi standar (E0) untuk beberapa kation.
Sel Volta yang memiliki potensial sel paling besar adalah ....
(A) Co|Co2+ || Au3+|Au
(B) Ca|Ca2+ || Au3+|Au
(C) Au|Au3+ || Ca2+|Ca
(D) Au|Au3+ || Sn2+|Sn
(E) Ca|Ca2+ || Sn2+|Sn
Pembahasan Soal #38 SBMPTN 2018
Jawaban yang tepat B.
Soal #39 SBMPTN-471-2018
Reaksi berikut:
4PH3(g) → P4(g) + 6H2(g)
mengikuti persamaan laju $- \dfrac{d[PH_3]}{dt}=k[PH_3]$.
Pada suatu percobaan dalam wadah 2 L, terbentuk 0,0048 mol gas H2 per detik ketika [PH3] = 0,1 M.
Tetapan laju (k) reaksi tersebut adalah ....
(A) 4,8 × 10–2 s–1
(B) 3,6 × 10–2 s–1
(C) 3,2 × 10–2 s–1
(D) 2,4 × 10–2 s–1
(E) 1,6 × 10–2 s–1
Pembahasan Soal #39 SBMPTN 2018
persamaan laju $- \dfrac{d[PH_3]}{dt}=k[PH_3]$
Tanda – pada $- \dfrac{d[PH_3]}{dt}$ ini menandakan laju pengurangan PH3
$\dfrac{d[H_2]}{dt} $ atau laju pembentukan $H_2 = \dfrac{0,0048 mol}{2~L.detik}$ = 0,0024 M/detik
$\dfrac{1}{4} \dfrac{d[PH_3]}{dt} = \dfrac{1}{6} \dfrac{d[H_2]}{dt} $
$ \dfrac{d[PH_3]}{dt} = \dfrac{4}{6} \dfrac{d[H_2]}{dt} $
$ k[PH_3] = \dfrac{4}{6} \dfrac{d[H_2]}{dt} $
$ k= \dfrac{4}{6} \dfrac{d[H_2]}{dt} : [PH_3] $
$ k= \dfrac{4}{6} \times 0,0024 M/detik : 0,1M $
$ k= 0,016 /detik = 1,6 \times 10^{-2} s^{-1} $
Jawaban yang tepat E.
Soal #40 SBMPTN-471-2018
Gas karbon monoksida apat dihasilkan melalui reaksi antara karbon dan gas karbondioksida menurut kesetimbangan berikut:
(A) 0,180
(B) 0,072
(C) 0,030
(D) 0,048
(E) 0,148
Pembahasan Soal #40 SBMPTN 2018
Kc = $\dfrac{[CO]^2}{[CO_2]}$
Kc = $\dfrac{[0,6/10]^2}{[0,5/10]}$
Kc = $\dfrac{0,0036}{0,05}$
Kc = 0,072
Jawaban yang tepat B
Soal #41 SBMPTN-471-2018
Larutan A dibuat dengan melarutkan 4,16 g BaCl2 (Mr = 208) ke dalam 2 kg air. Barium klorida terdisosiasi sempurna dalam air. Larutan B dibuat dengan melarutkan 15 g zat organik nonelektrolit ke dalam 1 kg air. Pad tekanan yang sama, ∆Tb larutan B = 2 ∆Tb larutan A. Massa molekul relatif zat organik tersebut adalah ....
(A) 100
(B) 250
(C) 400
(D) 700
(E) 1400
Pembahasan Soal #41 SBMPTN 2018
Larutan BaCl2 → larutan elektrolit dengan jumlah ion (n) sebanyak 3, terlarut sempurna α = 1.
∆Tb = m.Kb. (1+(n–1)α)
Larutan A:
∆Tb A = (4,16 g : 208 g/mol):2 kg × Kb × (1+(3–1).1)
∆Tb A = 0,01 × Kb × 3
∆Tb A = 0,03 × Kb
Untuk 15 g larutan B dalam 1 kg air:
∆Tb B = m × Kb dan ∆Tb B = 2∆Tb A
m × Kb = 2(0,03 × Kb)
m × Kb = 0,06 × Kb
m = 0,06 mol/kg
Jadi 0,06 mol larutan B ini mengandung 15 g zat organik
massa molar zat organik = 15 g : 0,06 mol
massa molar zat organik = 250 g/mol
Mr zat organik = 250
Jawaban yang tepat B
Soal #42 SBMPTN-471-2018
Nilai pH larutan obat batuk diatur dengan menambahan garam yang dibuat dari asam klorida dan amonia (Kb = 10–5). Jumlah garam yang ditambahkan ke dalam 300 mL obat batuk tersebut agar pH = 6 adalah .....
(A) 0,3 mmol
(B) 3 mmol
(C) 30 mmol
(D) 0,3 mol
(E) 3 mol
Pembahasan Soal #42 SBMPTN 2018
Soal ini boleh diterjemahkan ke dalam konsep hidrolisis garam, garam yang berasal dari asam kuat dan basa lemah.
pH = ½ (14 – pKb – log [G])
6 = ½ (14 – 5 – log [G])
12 = 9 – log [G]
3 = –log [G]
[G] = 10–3 M
Jumlah garam = volume garam × [G]
Jumlah garam = 300 mL × 10–3 M
Jumlah garam = 0,3 mmol
Jawaban yang tepat A.
Soal #43 SBMPTN-471-2018
Suatu reaksi dalam pelarut amonia cair berlangsung sebagai berikut.
NH4Cl(s) + NaNH2(s) ⇌ NaCl(s) + 2NH3(l)
Pasangan asam-basa konjugasi pada reaksi di atas adalah ....
(A) NH4Cl dan NaNH2
(B) NaNH2 dan NaCl
(C) NaCl dan NH3
(D) NH4Cl dan NaCl
(E) NH4Cl dan NH3
Pembahasan Soal #43 SBMPTN 2018
Pasangan asam basa konjugasi cirinya adalah kemiripan dengan selisih jumlah H sebanyak satu atom diluar dari kation yang berasal dari basa kuat dan di luar dari anion yang berasal dari asam kuat. Pasangan asam basa konjugasi selalu antara 1 pereaksi dengan 1 hasil reaksi.
Lebih mudahnya dituliskan seperti reaksi berikut:
NH4+ (asam) + NH2– (basa) ⇌ NH3 (basa) + NH3 (asam)
Bila dipasangkan secara lengkap maka NH4Cl dengan NH3 dan NaNH2 dengan NH3
Jawaban yang tepat E
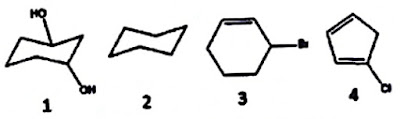
Soal #44 SBMPTN-471-2018
Senyawa berikut yang bersifat optis aktif adalah ....
(A) 1, 2, dan 3
(B) 2, 3, dan 4
(C) 1 dan 3
(D) 2 dan 4
(E) 4
Pembahasan Soal #44 SBMPTN 2018
Senyawa yang memiliki atom C kiral (atom C yang mengikat 4 gugus fungsi berlainan satu sama lain.
Yang memiliki atom C kiral adalah senyawa nomor 1 dan nomor 3.
Jawaban yang tepat C.
Soal #45 SBMPTN-471-2018
Kurva di atas menyajikan data energi ionisasi 5 unsur golongan utama. Unsur yang terletak pada golongan yang sama dalam tabel periodik adalah .....
(A) 1 dan 2
(B) 1 dan 3
(C) 2 dan 3
(D) 2 dan 4
(E) 2 dan 5
Pembahasan Soal #45 SBMPTN 2018
Unsur golongan utama yang segolongan dalam tabel periodik unsur biasanya akan memiliki tren (kecenderungan) yang hampir sama. Lonjakan energi ionisasinya terjadi pada ionisasi yang hampir sama pula. Dalam kurva soal ini yang memiliki ciri yang hampir serupa adalah 2 dan 3
Jawaban yang tepat C.
Soal #31 SBMPTN-471-2018
Produk oksidasi senyawa berikut adalah ....
Pembahasan Soal #31 SBMPTN 2018
Okisdasi alkohol skunder menghasilkan keton. Jawaban yang tepat adalah C
Jawaban yang tepat C.
Soal #32 SBMPTN-471-2018
Unsur F (nomor atom = 9) dan M (nomor atom = 54) membentuk molekul MF4. Bentuk molekul dan sifat kepolaran molekul MF4 adalah ....
(A) tetrahedral dan nopolar
(B) planar segiempat dan nonpolar
(C) primida dan polar
(D) jungkat-jungkit dan polar
(E) bipiramida segitiga dan polar
Pembahasan Soal #32 SBMPTN 2018
Elektron valensi F = 7 (konfigurasi elektron 1s2 2s2 2p5).
Elektron valensi M = 8 (konfigurasi elektron 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6).
MF4 total jumlah elektron valesi 8+(7×4) = 8+28 = 36,
Jumlah PEI = total ev : 8 = 36/8 = 4, sisa 4.
Jumlah PEB = sisa ev : 2 = 4/2 = 2 PEB
Jadi strukturnya adalah AX4E2 dengan bentuk bujur sangkar atau planar segiempat dan bersifat nonpolar karena posisi PEB berada pada posisi yang saling meniadakan kekuatan tarikan elektron.
Jawaban yang tepat B.
Soal #33 SBMPTN-471-2018
Persentase massa atom Ti (Ar = 48) dalam suatu mineral anorganik adalah 36%.
Jika tetapan Avogadro = 6,0 × 1023 , jumlah atom Ti yang terdapat dalam 4,0 g mineral tersebut adalah ....
(A) 6,0 × 1021
(B) 1,2 × 1022
(C) 1,8 × 1022
(D) 2,4 × 1022
(E) 3,0 × 1022
Pembahasan Soal #33 SBMPTN 2018
Ti dalam mineral = 36% × 4 g = 1,44 gram
Jumlah Ti 1,44 g : 48 g/mol = 0,03 mol
Jumlah partikel = 0,03 mol × 6 .1023 = 1,8 × 1022
Jawaban yang tepat C.
Soal #34 SBMPTN-471-2018
Reaksi berikut terjadi pada 1600 oC.
2B2O3 + 7C → B4C + 6CO
Dalam suatu reaksi, digunakan 14,0 g B2O3 (Mr = 70) dan 9,6 g C (Ar = 12). Jika reaksi memberikan persentase hasil sebesar 80%, massa B4C (Mr = 56) yang diperoleh adalah .....
(A) 11,20 g
(B) 5,60 g
(C) 4,48 g
(D) 2,24 g
(E) 1,12 g
Pembahasan Soal #34 SBMPTN 2018
14,0 g B2O3 = 14,0 g : 70 g/mol = 0,2 mol
9,6 g C = 9,6 g : 12 g/mol = 0,8 mol
Reaksi
|
:
|
2B2O3
|
+
|
7C
|
→
|
B4C
|
+
|
6CO
|
Awal
|
:
|
0,2 mol
|
0,8 mol
|
-
|
-
| |||
Bereaksi
|
:
|
-0,2 mol
|
-7/2 × 0,2 mol
|
1/2 × 0,2 mol
|
6/2 × 0,2 mol
| |||
Akhir
|
:
|
-
|
0,1 mol
|
0,1 mol
|
0,6 mol
|
Bila yang dihasilkan 100 produk maka massanya adalah 0,1 mol x 56 g/mol = 5,6 g B4C.
Karena persentase hasil hanya 80% maka massa B4C = 80% × 5,6 gram = 4,48 g.
Jawaban yang tepat C.
Soal #35 SBMPTN-471-2018
Gas metanol dapat dibuat dengan mereaksikan gas karbon monoksida dan gas hidrogen menurut reaksi berikut.
CO(g) + 2H2(g) → CH3OH(g)
Gas hasil reaksi tersebut pada V dan T tetap memberikan tekanan 6 atm. Jika kedua pereaksi habis bereaksi, tekanan total gas sebelum reaksi adalah .....
(A) 6 atm
(B) 12 atm
(C) 18 atm
(D) 24 atm
(E) 30 atm
Pembahasan Soal #35 SBMPTN 2018
Reaksi
|
:
|
CO
|
+
|
2H2
|
→
|
CH3OH
|
Awal
|
:
|
6 atm
|
12 atm
|
-
| ||
Bereaksi
|
:
|
-6 atm
|
-12 atm
|
+6 atm
| ||
Kesetimbangan
|
:
|
-
|
-
|
6 atm
|
Pada reaksi gas-gas volume sebanding dengan koefisien atau jumlah zat-zat yang terdapat dalam keadaan
Jawaban yang tepat C.
Soal #36 SBMPTN-471-2018
Data nilai energi ikatan rata-rata diket sebagai berikut.
Ikatan
|
Energi Ikatan (kJ mol–1 )
|
C–H
|
410
|
C–F
|
485
|
F–F
|
159
|
H–F
|
565
|
Jika entalpi reaksi : C2H5F(g) + 2F2(g) → C2H3F3 (g) + 2HF (g)
Nilai entalpi reaksi di atas adalah ....
(A) –481 kJ mol–1
(B) +481 kJ mol–1
(C) –962 kJ mol–1
(D) +962 kJ mol–1
(E) +1443 kJ mol–1
Pembahasan Soal #36 SBMPTN 2018
Jawaban yang tepat C.
Soal #37 SBMPTN-471-2018
Dalam pelarut HF , reaksi disproporsionasi iodium (I2) berlangsung sebagai berikut.
3I2 + 5AgF → 5AgI + IF5
Jumlah mol elektron yang terlibat pada reaksi disproporsionasi 0,3 mol iodium adalah ....
(A) 0,1 mol
(B) 0,2 mol
(C) 0,3 mol
(D) 0,4 mol
(E) 0,5 mol
Pembahasan Soal #37 SBMPTN 2018
Reaksi redoks yang terjadi:
Reduksi: I2 + 2e– → 2I–
Oksidasi: I2 → 2I5+ + 10e10e–
Reduksi: 5I2 + 10e– → 10I–
Oksidasi: I2 → 2I5+ + 10e–
Total: 6I2 + 10e– → 10I– + 2I5+ + 10e–
Total disederhanakan: 3I2 + 5e– → 5I– + I5+ + 5e–
Reaksi bersih: 3I2 → 5I– + I5+
Elektron yang terlibat (transfer elektron yang terjadi) sebanyak 5 elektron. Jumlah mol zat dan jumlah mol elektron akan sebanding dengan koefisien masing-masing.
Jumlah mol elektron yang terlibat : jumlah mol I2 = koefisien elektron yang terlibat : Koefisien Cl2
Jumlah mol elektron yang terlibat : 0,3 mol = 5 : 3
Jumlah mol elektron yang terlibat = 5/3 × 0,3 mol
Jumlah mol elektron yang terlibat = 0,5 mol
Jawaban yang tepat E.
Soal #38 SBMPTN-471-2018
Berikut ini adalah data potensial reduksi standar (E0) untuk beberapa kation.
| Au3+ + 3e– → Au | E0 = +1,50 V |
| Sn2+ + 2e– → Sn | E0 = –0,14 V |
| Ca2+ + 2e– → Ca | E0 = –2,87 V |
| Co2+ + 2e– → Co | E0 = –0,28 V |
Sel Volta yang memiliki potensial sel paling besar adalah ....
(A) Co|Co2+ || Au3+|Au
(B) Ca|Ca2+ || Au3+|Au
(C) Au|Au3+ || Ca2+|Ca
(D) Au|Au3+ || Sn2+|Sn
(E) Ca|Ca2+ || Sn2+|Sn
Pembahasan Soal #38 SBMPTN 2018
| Co|Co2+ || Au3+|Au | E0 sel = (+0,28 +1,50) V = +1,78 V |
| Ca|Ca2+ || Au3+|Au | E0 sel = (+2,87 + 1,50) V = +4,37 V |
| Au|Au3+ || Ca2+|Ca | E0 sel = (–1,50 – 2,87) V = –4,37 V |
| Au|Au3+ || Sn2+|Sn | E0 sel = (–1,50 – 0,14) V = –1,64 V |
| Ca|Ca2+ || Sn2+|Sn | E0 sel = (+2,87 – 0,14) V = –2,73 V |
Jawaban yang tepat B.
Soal #39 SBMPTN-471-2018
Reaksi berikut:
4PH3(g) → P4(g) + 6H2(g)
mengikuti persamaan laju $- \dfrac{d[PH_3]}{dt}=k[PH_3]$.
Pada suatu percobaan dalam wadah 2 L, terbentuk 0,0048 mol gas H2 per detik ketika [PH3] = 0,1 M.
Tetapan laju (k) reaksi tersebut adalah ....
(A) 4,8 × 10–2 s–1
(B) 3,6 × 10–2 s–1
(C) 3,2 × 10–2 s–1
(D) 2,4 × 10–2 s–1
(E) 1,6 × 10–2 s–1
Pembahasan Soal #39 SBMPTN 2018
persamaan laju $- \dfrac{d[PH_3]}{dt}=k[PH_3]$
Tanda – pada $- \dfrac{d[PH_3]}{dt}$ ini menandakan laju pengurangan PH3
$\dfrac{d[H_2]}{dt} $ atau laju pembentukan $H_2 = \dfrac{0,0048 mol}{2~L.detik}$ = 0,0024 M/detik
$\dfrac{1}{4} \dfrac{d[PH_3]}{dt} = \dfrac{1}{6} \dfrac{d[H_2]}{dt} $
$ \dfrac{d[PH_3]}{dt} = \dfrac{4}{6} \dfrac{d[H_2]}{dt} $
$ k[PH_3] = \dfrac{4}{6} \dfrac{d[H_2]}{dt} $
$ k= \dfrac{4}{6} \dfrac{d[H_2]}{dt} : [PH_3] $
$ k= \dfrac{4}{6} \times 0,0024 M/detik : 0,1M $
$ k= 0,016 /detik = 1,6 \times 10^{-2} s^{-1} $
Jawaban yang tepat E.
Soal #40 SBMPTN-471-2018
Gas karbon monoksida apat dihasilkan melalui reaksi antara karbon dan gas karbondioksida menurut kesetimbangan berikut:
CO2(g) + C(s) ⇌ 2CO(g)
Jika dalam wadah 10 L dan suhu tertentu, campuran 0,8 mol CO2 dan serbuk karbon berlebih menghasilkan 0,6 mol gas CO. Tetapan kesetimbangan, Kc , reaksi tersebut adalah ....(A) 0,180
(B) 0,072
(C) 0,030
(D) 0,048
(E) 0,148
Pembahasan Soal #40 SBMPTN 2018
Reaksi
|
CO2(g)
|
+
|
C(s)
|
⇌
|
2CO(g)
|
Awal
|
0,8 mol
|
~ mol
|
-
| ||
Bereaksi
|
-0,3 mol
|
-0,3 mol
|
+0,6 mol
| ||
Kesetimbangan
|
0,5 mol
|
~
|
0,6 mol
|
Kc = $\dfrac{[CO]^2}{[CO_2]}$
Kc = $\dfrac{[0,6/10]^2}{[0,5/10]}$
Kc = $\dfrac{0,0036}{0,05}$
Kc = 0,072
Jawaban yang tepat B
Soal #41 SBMPTN-471-2018
Larutan A dibuat dengan melarutkan 4,16 g BaCl2 (Mr = 208) ke dalam 2 kg air. Barium klorida terdisosiasi sempurna dalam air. Larutan B dibuat dengan melarutkan 15 g zat organik nonelektrolit ke dalam 1 kg air. Pad tekanan yang sama, ∆Tb larutan B = 2 ∆Tb larutan A. Massa molekul relatif zat organik tersebut adalah ....
(A) 100
(B) 250
(C) 400
(D) 700
(E) 1400
Pembahasan Soal #41 SBMPTN 2018
Larutan BaCl2 → larutan elektrolit dengan jumlah ion (n) sebanyak 3, terlarut sempurna α = 1.
∆Tb = m.Kb. (1+(n–1)α)
Larutan A:
∆Tb A = (4,16 g : 208 g/mol):2 kg × Kb × (1+(3–1).1)
∆Tb A = 0,01 × Kb × 3
∆Tb A = 0,03 × Kb
Untuk 15 g larutan B dalam 1 kg air:
∆Tb B = m × Kb dan ∆Tb B = 2∆Tb A
m × Kb = 2(0,03 × Kb)
m × Kb = 0,06 × Kb
m = 0,06 mol/kg
Jadi 0,06 mol larutan B ini mengandung 15 g zat organik
massa molar zat organik = 15 g : 0,06 mol
massa molar zat organik = 250 g/mol
Mr zat organik = 250
Jawaban yang tepat B
Soal #42 SBMPTN-471-2018
Nilai pH larutan obat batuk diatur dengan menambahan garam yang dibuat dari asam klorida dan amonia (Kb = 10–5). Jumlah garam yang ditambahkan ke dalam 300 mL obat batuk tersebut agar pH = 6 adalah .....
(A) 0,3 mmol
(B) 3 mmol
(C) 30 mmol
(D) 0,3 mol
(E) 3 mol
Pembahasan Soal #42 SBMPTN 2018
Soal ini boleh diterjemahkan ke dalam konsep hidrolisis garam, garam yang berasal dari asam kuat dan basa lemah.
pH = ½ (14 – pKb – log [G])
6 = ½ (14 – 5 – log [G])
12 = 9 – log [G]
3 = –log [G]
[G] = 10–3 M
Jumlah garam = volume garam × [G]
Jumlah garam = 300 mL × 10–3 M
Jumlah garam = 0,3 mmol
Jawaban yang tepat A.
Soal #43 SBMPTN-471-2018
Suatu reaksi dalam pelarut amonia cair berlangsung sebagai berikut.
NH4Cl(s) + NaNH2(s) ⇌ NaCl(s) + 2NH3(l)
Pasangan asam-basa konjugasi pada reaksi di atas adalah ....
(A) NH4Cl dan NaNH2
(B) NaNH2 dan NaCl
(C) NaCl dan NH3
(D) NH4Cl dan NaCl
(E) NH4Cl dan NH3
Pembahasan Soal #43 SBMPTN 2018
Pasangan asam basa konjugasi cirinya adalah kemiripan dengan selisih jumlah H sebanyak satu atom diluar dari kation yang berasal dari basa kuat dan di luar dari anion yang berasal dari asam kuat. Pasangan asam basa konjugasi selalu antara 1 pereaksi dengan 1 hasil reaksi.
Lebih mudahnya dituliskan seperti reaksi berikut:
NH4+ (asam) + NH2– (basa) ⇌ NH3 (basa) + NH3 (asam)
Bila dipasangkan secara lengkap maka NH4Cl dengan NH3 dan NaNH2 dengan NH3
Jawaban yang tepat E
Soal #44 SBMPTN-471-2018
Senyawa berikut yang bersifat optis aktif adalah ....
(A) 1, 2, dan 3
(B) 2, 3, dan 4
(C) 1 dan 3
(D) 2 dan 4
(E) 4
Pembahasan Soal #44 SBMPTN 2018
Senyawa yang memiliki atom C kiral (atom C yang mengikat 4 gugus fungsi berlainan satu sama lain.
Yang memiliki atom C kiral adalah senyawa nomor 1 dan nomor 3.
Jawaban yang tepat C.
Soal #45 SBMPTN-471-2018
Kurva di atas menyajikan data energi ionisasi 5 unsur golongan utama. Unsur yang terletak pada golongan yang sama dalam tabel periodik adalah .....
(A) 1 dan 2
(B) 1 dan 3
(C) 2 dan 3
(D) 2 dan 4
(E) 2 dan 5
Pembahasan Soal #45 SBMPTN 2018
Unsur golongan utama yang segolongan dalam tabel periodik unsur biasanya akan memiliki tren (kecenderungan) yang hampir sama. Lonjakan energi ionisasinya terjadi pada ionisasi yang hampir sama pula. Dalam kurva soal ini yang memiliki ciri yang hampir serupa adalah 2 dan 3
Jawaban yang tepat C.



Tidak ada komentar:
Posting Komentar