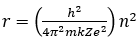Setelah perbandingan q/m elektron ditemukan, fisikawan mencoba untuk mengukur besarnya nilai q itu sendiri. Pada tahun 1910-1913, Robert Andrew Milikan seorang ilmuwan asal Amerika berhasil mengukur muatan elektron. Alat-alat yang digunakan dalam percobaan Milikan ini ditunjukan secara skematik pada gambar 1.
 |
| Gambar 1: Pecobaan Milikan |
Pada gambar 1, tampak teropong dan sumber cahaya. Teropong digunakan untuk melihat apa yang terjadi dalam tabung. Sumber cahaya membantu menerangi bagian dalam tabung ini. Di dalam tabung terdapat keping A dan B yang dapat diberi muatan. Keping ini berlubang ditengahnya. Tepat di atas lubang terdapat sebuah penyemprot yang dapat menyemprotkan butir-butir minyak.
Percobaan dilakukan dengan menyemprotkan minyak di dalam tabung. Ketika disemprotkan, sebagian tetes minyak menjadi bermuatan, gerakan tetes dapat diatur dengan mengatur medan listrik dalam tabung. Ketika tidak ada medan listrik di dalam tabung, gaya yang bekerja pada tetes minyak hanyalah gaya berat dan gaya gesek kv. (Sebenarnya juga terdapat gaya apung, namun gaya ini sangat kecil sehingga dapat kita abaikan). Pada keadaan seperti ini tetes minyak yang akan bergerak ke bawah dengan kelajuan terminal vt (gambar 2a).
 |
| Gambar 2 |
Ketika medan listrik dalam tabung dinyalakan, medan listrik diatur sedemikian sehingga tetes minyak bergerak ke atas dengan kelajuan rendah, vr (gambar 2b). Dengan mengamati gerak tetes minyak dalam tabung melalui teropong, kelajuan vt dan vr dapat diukur. Dari persamaan gerak untuk kedua keadaan gerak seperti pada gambar, dan dengan mengeleminisasi konstanta gesekan, k, diperoleh
Medan listrik E dihitung dari beda potensial ∆V dibagi jarak antara pelat d, sedangkan massa tetes minyak m dihitung dari massa jenis dikali volumenya (massa tetes minyak ini tidak dapat ditimbang, tidak ada ada timbangan yang cukup ketelitiannya untuk mengukur massa tetes minyak ini). Untuk menghitung volume, jari-jari tetes minyak didapat dari teorema Stokes yang dimodifikasi (untuk kecepatan rendah).
Dari ribuan tetes, Milikan menemukan bahwa tetes merupakan kelipatan dari suatu nilai. Uatan Ia mendapatkan muatan tetes: -6,4 x 10-19 C, -1,44 x 10-19 C, -8 x 10-19 C, -,1,6 x 10-19 C, 4,8 x 10-19 C, dan -1,6 x 10-18 C. Tidak pernah ia mendapatkan muatan muatan -2,2 x 10-19 C atau 5,6 x 10-19 C dan tidak perna ia mendapatkan tetes yang muatannya kurang dari -1,6 x 10-19 C.
Jadi dapat dikatakan bahwa muatan tetes selalu kelipatan bilangan bulat dari muatan terkecil qe = -1,6 x 10-19 C atau muatan tetes minyak bersifat diskrit (tidak kontinu artinya hanya mengambil harga-harga tertentu saja, yaitu 1qe, 2qe, 3qe, dan seterusnya),
Muatan tetes = (1, 2, 3, 4, 5, . . .) x qe
Dengan
qe = -1,6 x 10-19 C
percobaan-percobaan modern yang sangat akurat menunjukkan bahwa
qe = -1,60217733 x 10-19 C
sejak penemuan Milikan banyak percobaan dilakukan untuk menunjukkan bahwa qe merupakan muatan partikel terkecil yang menjadi penyusun atom. Juga dibuktikan secara langsung bahwa berkas sinar katoda terdiri dari partikel yang muatannya qe. Dengan demikian, dapat disimpulkan bahwa partikel terkecil yang menjadi penyusun atom adalah elektron yang muatannya sebesar qe.
Dengan menggunakan nilai qe pada hasil q/m dari percobaan Thomson, kita dapat peroleh besarnya massa elektron me.
q/m = 1,76 x 1011 C/kg
m = q/(1,76 x 1011 C/kg) = 1,6 x 10-19 C/(1,76 x 1011 C/kg) = 9,1 x 10-31 kg
atau perhitungan yang lebih akurat memberikan massa elektron adalah
me = 9,1093897 x 10-31 kg
Catatam: Dalam perkembangan fisika modern ada teori yang mengatakan bahwa muatan kuark lebih kecil daripada muatan elektron. Namun tidak pernah ditemukan kuark tunggal. Kuark selalu ditemukan berpasangan atau bertiga yang jumlah total muatannya selalu kelipatan bilangan bulat dari harga mutlat muatan elektron. Jadi sampai saat ini boleh dikatakan muatan terkecil adalah muatan elektron.